एनसीईआरटी Solution: कक्षा 12 रसायन विज्ञान अध्याय 1 – विलयन
यह प्रश्न NCERT Class 12 Chemistry के Solutions अध्याय (विलयन) से संबंधित है। यहाँ परासरण दाब, मोलरता और सांद्रता से जुड़े महत्वपूर्ण numericals को आसान भाषा में step-by-step समझाया गया है। यह content बोर्ड परीक्षा और competitive exams दोनों की तैयारी के लिए उपयोगी है।
Q.1: विलयन को परिभाषित कीजिए। कितने प्रकार के विभिन्न विलयन संभव हैं।
प्रत्येक प्रकार के विलयन के संबंध में एक उदाहरण देकर संक्षेप में लिखिए।
उत्तर
विलयन की परिभाषा:वह समांगी मिश्रण जिसमें एक या अधिक पदार्थ किसी अन्य पदार्थ में पूर्णतः घुले हों, विलयन कहलाता है।
विलयन के प्रकार:
विलयन मुख्यतः तीन प्रकार के होते हैं।
व्याख्या
1. ठोस विलयन (Solid Solution)परिभाषा: जिस विलयन में विलेय और विलायक दोनों ठोस अवस्था में हों।
उदाहरण: पीतल (जस्ता + तांबा)
2. द्रव विलयन (Liquid Solution)
परिभाषा: जिस विलयन में विलायक द्रव अवस्था में हो।
उदाहरण: जल में नमक, जल में चीनी
3. गैसीय विलयन (Gaseous Solution)
परिभाषा: जिस विलयन में विलायक गैस अवस्था में हो।
उदाहरण: वायु (नाइट्रोजन में ऑक्सीजन, CO₂ आदि)
अवस्था के आधार पर विलयन के कुछ सामान्य उदाहरण:
| विलेय | विलायक | विलयन का उदाहरण |
|---|---|---|
| ठोस | द्रव | नमक + जल |
| द्रव | द्रव | अल्कोहल + जल |
| गैस | द्रव | CO₂ + जल (सोडा जल) |
| गैस | गैस | वायु |
क्या आप जानते हैं?
• विलयन हमेशा समांगी मिश्रण होता है।• विलयन में विलायक की मात्रा अधिक होती है।
• जल को सार्वभौमिक विलायक कहा जाता है।
• ठोस विलयन के उदाहरण अक्सर मिश्रधातु होते हैं।
• परीक्षा में वायु को गैसीय विलयन के रूप में लिखना न भूलें।
Q.2: ऐसे ठोस विलयन का उदाहरण दीजिए, जिसमें विलेय कोई गैस हो।
उत्तर
पैलेडियम में हाइड्रोजन गैस का विलयनयह एक ऐसा ठोस विलयन है जिसमें विलेय गैस (H2) और विलायक ठोस (Pd) होता है।
व्याख्या
समझने के लिए:कुछ धातुओं में गैसें अपने कणों के बीच की खाली जगह (Interstitial space) में समा जाती हैं। ऐसी स्थिति में बनने वाला विलयन ठोस विलयन कहलाता है।
इस उदाहरण में:
विलेय = हाइड्रोजन गैस (H2)
विलायक = पैलेडियम धातु (Pd)
अवस्था = ठोस विलयन
हाइड्रोजन गैस पैलेडियम की जाली संरचना में प्रवेश कर जाती है और एक समांगी ठोस विलयन बनता है।
क्या आप जानते हैं?
• गैस + ठोस से बना विलयन भी ठोस विलयन कहलाता है।• ऐसे विलयन को Interstitial solid solution कहते हैं।
• पैलेडियम हाइड्रोजन को बहुत अधिक मात्रा में अवशोषित कर सकता है।
• परीक्षा में गैस वाले ठोस विलयन का सबसे standard उदाहरण यही है।
• ठोस विलयन के अधिकांश उदाहरण धातुओं से जुड़े होते हैं।
Q.3 निम्न पदों को परिभाषित कीजिए—
(i) मोल अंश
(ii) मोललता
(iii) मोलरता
(iv) द्रव्यमान प्रतिशत
उत्तर
नीचे दिए गए सभी पदों की परिभाषाएँ
संक्षेप एवं परीक्षा-उपयोगी रूप में दी गई हैं।
व्याख्या
(i) मोल अंश (Mole Fraction)परिभाषा: किसी विलयन में किसी घटक के मोलों की संख्या और विलयन में उपस्थित कुल मोलों की संख्या के अनुपात को मोल अंश कहते हैं।
सूत्र:
मोल अंश = घटक के मोल / कुल मोल
(ii) मोललता (Molality)
परिभाषा: विलायक के 1 किलोग्राम में घुले विलेय के मोलों की संख्या को मोललता कहते हैं।
सूत्र:
मोललता = विलेय के मोल / विलायक का द्रव्यमान (kg में)
(iii) मोलरता (Molarity)
परिभाषा: विलयन के 1 लीटर में उपस्थित विलेय के मोलों की संख्या को मोलरता कहते हैं।
सूत्र:
मोलरता = विलेय के मोल / विलयन का आयतन (लीटर में)
(iv) द्रव्यमान प्रतिशत (Mass Percentage)
परिभाषा: विलयन के कुल द्रव्यमान में उपस्थित विलेय के द्रव्यमान का प्रतिशत द्रव्यमान प्रतिशत कहलाता है।
सूत्र:
द्रव्यमान प्रतिशत = विलेय का द्रव्यमान / विलयन का कुल द्रव्यमान × 100
क्या आप जानते हैं?
• मोल अंश ताप पर निर्भर नहीं करता।• मोललता ताप परिवर्तन से नहीं बदलती।
• मोलरता ताप पर निर्भर करती है।
• द्रव्यमान प्रतिशत में हमेशा द्रव्यमान का प्रयोग होता है।
• प्रतियोगी परीक्षाओं में इन चारों पदों की परिभाषाएँ सीधे पूछी जाती हैं।
Q.4 प्रयोगशाला कार्य के लिए प्रयोग में लाया जाने वाला सान्द्र नाइट्रिक अम्ल
द्रव्यमान की दृष्टि से नाइट्रिक अम्ल का 68% जलीय विलयन है।
यदि इस विलयन का घनत्व 1.504 g mL−1 हो,
तो अम्ल के इस नमूने की मोलरता क्या होगी?
उत्तर
दिए गए नाइट्रिक अम्ल विलयन की मोलरता
= 16.2 M (लगभग)
व्याख्या
दिया गया:नाइट्रिक अम्ल का द्रव्यमान प्रतिशत = 68% (w/w)
विलयन का घनत्व = 1.504 g mL−1
HNO3 का मोलर द्रव्यमान = 63 g mol−1
Step 1: 68% (w/w) का अर्थ
68% (w/w) का अर्थ है कि 100 g विलयन में:
नाइट्रिक अम्ल (HNO3) = 68 g
जल = 32 g
Step 2: नाइट्रिक अम्ल के मोल
सूत्र:
मोल = विलेय का द्रव्यमान / मोलर द्रव्यमान
HNO3 के मोल = 68 g / 63 g mol−1 = 1.08 mol
Step 3: 100 g विलयन का आयतन
हम जानते हैं कि:
घनत्व = द्रव्यमान / आयतन
आयतन = द्रव्यमान / घनत्व = 100 g / 1.504 g mL−1 = 66.5 mL
लीटर में आयतन = 0.0665 L
Step 4: मोलरता की गणना
सूत्र:
मोलरता = विलेय के मोल / विलयन का आयतन (लीटर में)
M = 1.08 mol / 0.0665 L = 16.2 mol L−1
क्या आप जानते हैं?
• w/w प्रतिशत वाले प्रश्नों में हमेशा 100 g विलयन मानना सबसे आसान तरीका है।• यदि घनत्व दिया हो तो मोलरता अवश्य निकाली जा सकती है।
• सान्द्र अम्लों की मोलरता सामान्यतः बहुत अधिक होती है।
• HNO3 का मोलर द्रव्यमान (63 g mol−1) परीक्षा में बार-बार पूछा जाता है।
• मोलरता ताप पर निर्भर करती है, इसलिए घनत्व का सही प्रयोग आवश्यक है।
Q.5 ग्लूकोज का एक जलीय विलयन 10% (w/w) है।
विलयन की मोललता तथा विलयन में प्रत्येक घटक का मोल अंश क्या है?
यदि विलयन का घनत्व 1.2 g mL−1 हो, तो विलयन की मोलरता क्या होगी?
उत्तर
• विलयन की मोललता = 0.62 mol kg−1• ग्लूकोज का मोल अंश = 0.012
• जल का मोल अंश = 0.988
• विलयन की मोलरता = 0.67 mol L−1
व्याख्या
दिया गया:ग्लूकोज विलयन = 10% (w/w)
विलयन का घनत्व = 1.2 g mL−1
ग्लूकोज का मोलर द्रव्यमान = 180 g mol−1
जल का मोलर द्रव्यमान = 18 g mol−1
Step 1: 10% (w/w) का अर्थ
10% (w/w) का अर्थ है कि 100 g विलयन में:
• ग्लूकोज = 10 g
• जल = 90 g
जल का द्रव्यमान = 90 g
किलोग्राम में बदलने के लिए 1000 से भाग देंगे:
= 0.090 kg
Step 2: मोललता की गणना
मोललता की गणना से पहले विलेय के मोल ज्ञात करेंगे।
ग्लूकोज के मोल = 10 g / 180 g mol−1 = 0.0556 mol
अब मोललता होगी:
मोललता = ग्लूकोज के मोल / विलायक (जल) का द्रव्यमान (kg में)
= 0.0556 mol / 0.090 kg = 0.62 mol kg−1
Step 3: मोल अंश की गणना
सूत्र: मोल अंश = घटक के मोल / कुल मोल
जल के मोल = जल का द्रव्यमान / जल का मोलर द्रव्यमान = 90 g / 18 g mol−1 = 5 mol
कुल मोल = जल के मोल + ग्लूकोज के मोल = 5 + 0.0556 = 5.0556 mol
ग्लूकोज का मोल अंश = 0.0556 / 5.0556 = 0.012
जल का मोल अंश = 5 / 5.0556 = 0.988
Step 4: मोलरता की गणना
मोलरता ज्ञात करने के लिए पहले घनत्व से विलयन का आयतन ज्ञात करेंगे।
विलयन का घनत्व = 1.2 g mL−1
अतः 100 g विलयन का आयतन:
आयतन = विलयन का द्रव्यमान / विलयन का घनत्व
= 100 g / 1.2 g mL−1 = 83.3 mL
लीटर में आयतन = 0.0833 L
मोलरता = विलेय (ग्लूकोज) के मोल / विलयन का आयतन (लीटर में)
= 0.0556 mol / 0.0833 L = 0.67 mol L−1
क्या आप जानते हैं?
• w/w प्रश्नों में हमेशा 100 g विलयन मानना सबसे आसान तरीका है।• मोललता में केवल जल का द्रव्यमान (kg में) लिया जाता है।
• यदि घनत्व दिया हो तो मोलरता अवश्य निकाली जा सकती है।
• मोल अंश का कुल योग हमेशा 1 होता है।
• ग्लूकोज का मोलर द्रव्यमान 180 g mol−1 परीक्षा में बार-बार पूछा जाता है।
Q.7 द्रव्यमान की दृष्टि से 25% विलयन के 300 g तथा
40% विलयन के 400 g को आपस में मिलाने पर
प्राप्त मिश्रण का द्रव्यमान प्रतिशत सांद्रण ज्ञात कीजिए।
उत्तर
• प्राप्त मिश्रण का द्रव्यमान प्रतिशत
= 33.57% (लगभग)
व्याख्या
दिया गया:पहला विलयन = 25% (w/w), द्रव्यमान = 300 g
दूसरा विलयन = 40% (w/w), द्रव्यमान = 400 g
Step 1: पहले विलयन में विलेय का द्रव्यमान
25% (w/w) का अर्थ है कि 100 g विलयन में 25 g विलेय होता है।
अतः 300 g विलयन में विलेय का द्रव्यमान:
= 25 × 300 / 100
= 75 g
Step 2: दूसरे विलयन में विलेय का द्रव्यमान
40% (w/w) का अर्थ है कि 100 g विलयन में 40 g विलेय होता है।
अतः 400 g विलयन में विलेय का द्रव्यमान:
= 40 × 400 / 100
= 160 g
Step 3: मिश्रण में कुल विलेय एवं कुल विलयन
कुल विलेय का द्रव्यमान:
= 75 g + 160 g
= 235 g
कुल विलयन का द्रव्यमान:
= 300 g + 400 g
= 700 g
Step 4: द्रव्यमान प्रतिशत की गणना
सूत्र:
द्रव्यमान प्रतिशत = विलेय का द्रव्यमान / विलयन का कुल द्रव्यमान × 100
= 235 g / 700 g × 100
= 33.57%
क्या आप जानते हैं?
• w/w प्रश्नों में पहले विलेय का द्रव्यमान निकालना सबसे आसान तरीका है।• विलयनों को मिलाने पर विलेय का द्रव्यमान जुड़ता है।
• अंतिम प्रतिशत निकालते समय कुल विलयन का द्रव्यमान लेना न भूलें।
• ऐसे प्रश्नों में molar mass की आवश्यकता नहीं होती।
Q.8 222.6 g एथिलीन ग्लाइकोल, C2H4(OH)2 तथा
200 g जल को मिलाकर प्रतिहिम मिश्रण बनाया गया।
विलयन की मोललता की गणना कीजिए।
यदि विलयन का घनत्व 1.072 g mL−1 हो,
तो विलयन की मोलरता ज्ञात कीजिए।
उत्तर
• विलयन की मोललता = 17.96 mol kg−1 (लगभग)• विलयन की मोलरता = 10.58 mol L−1 (लगभग)
व्याख्या
दिया गया:एथिलीन ग्लाइकोल C2H4(OH)2 का द्रव्यमान = 222.6 g
एथिलीन ग्लाइकोल का मोलर द्रव्यमान = 62 g mol−1
जल का द्रव्यमान = 200 g = 0.200 kg
विलयन का घनत्व = 1.072 g mL−1
Step 1: एथिलीन ग्लाइकोल के मोल
सूत्र: मोल = एथिलीन ग्लाइकोल का द्रव्यमान / मोलर द्रव्यमान
मोल = 222.6 g / 62 g mol−1
= 3.59 mol
Step 2: मोललता की गणना
सूत्र: मोललता = विलेय (एथिलीन ग्लाइकोल) के मोल / विलायक (जल) का द्रव्यमान (kg में)
जल का द्रव्यमान = 200 g = 0.200 kg
मोललता = 3.59 mol / 0.200 kg
= 17.96 mol kg−1
Step 3: विलयन का कुल द्रव्यमान
कुल द्रव्यमान = एथिलीन ग्लाइकोल का द्रव्यमान + जल का द्रव्यमान
= 222.6 g + 200 g
= 422.6 g
Step 4: विलयन का आयतन
सूत्र: आयतन = विलयन का द्रव्यमान / घनत्व
आयतन = 422.6 g / 1.072 g mL−1
= 394.2 mL
लीटर में आयतन = 0.3942 L
Step 5: मोलरता की गणना
सूत्र: मोलरता = विलेय (एथिलीन ग्लाइकोल) के मोल / विलयन का आयतन (लीटर में)
मोलरता = 3.59 mol / 0.3942 L
= 10.58 mol L−1
क्या आप जानते हैं?
• मोललता निकालते समय केवल विलायक (जल) का द्रव्यमान लिया जाता है।• प्रतिहिम (Antifreeze) मिश्रणों में एथिलीन ग्लाइकोल सामान्य विलेय होता है।
• यदि घनत्व दिया हो तो मोलरता आसानी से निकाली जा सकती है।
• मोललता ताप पर निर्भर नहीं करती, जबकि मोलरता करती है।
• C2H4(OH)2 का मोलर द्रव्यमान 62 g mol−1 परीक्षा में याद रखना उपयोगी है।
Q.9 एक पीने के जल का नमूना क्लोरोफॉर्म (CHCl3) से,
कैंसरजन्य समझे जाने की सीमा तक बहुत अधिक प्रदूषित है।
इसमें प्रदूषण की सीमा 15 ppm (द्रव्यमान में) है।
(i) इसे द्रव्यमान प्रतिशत में व्यक्त कीजिए।
(ii) जल के नमूने में क्लोरोफॉर्म की मोललता ज्ञात कीजिए।
(i) इसे द्रव्यमान प्रतिशत में व्यक्त कीजिए।
(ii) जल के नमूने में क्लोरोफॉर्म की मोललता ज्ञात कीजिए।
उत्तर
• (i) द्रव्यमान प्रतिशत = 0.0015 % (w/w)• (ii) क्लोरोफॉर्म की मोललता = 1.26 × 10−4 mol kg−1
व्याख्या
दिया गया:क्लोरोफॉर्म की मात्रा = 15 ppm (द्रव्यमान में)
इसका अर्थ है कि 106 g जल में CHCl3 = 15 g
अथवा 1 kg जल में CHCl3 = 15 mg = 0.015 g
CHCl3 का मोलर द्रव्यमान:
= 12 + 1 + (35.5 × 3)
= 119.5 g mol−1
(i) Step 1: ppm को द्रव्यमान प्रतिशत में बदलना
सिद्धांत:
ppm का अर्थ है 106 भागों में विलेय के भाग।
अर्थात 15 ppm का अर्थ है कि 106 भागों वाले विलयन में विलेय के 15 भाग उपस्थित हैं।
अब हम आसानी से द्रव्यमान प्रतिशत ज्ञात कर सकते हैं:
द्रव्यमान प्रतिशत = (विलेय के भाग / विलयन के भाग) × 100
= 15 / 106 × 100
= 0.0015%
(ii) Step 2: क्लोरोफॉर्म के मोल
सूत्र: मोल = विलेय का द्रव्यमान / मोलर द्रव्यमान
CHCl3 के मोल = 0.015 g / 119.5 g mol−1
= 1.26 × 10−4 mol
Step 3: मोललता की गणना
सूत्र (हिंदी में):
मोललता = विलेय के मोल / विलायक का द्रव्यमान (kg में)
यहाँ जल का द्रव्यमान = 1 kg
मोललता = (1.26 × 10−4 mol) / 1 kg
= 1.26 × 10−4 mol kg−1
क्या आप जानते हैं?
• ppm का अर्थ है parts per million (106 में भाग)।• जल में ppm को समझने के लिए 1 ppm ≈ 1 mg L−1 मानना आसान होता है।
• बहुत dilute विलयनों में मोललता निकालना सरल होता है।
• प्रदूषण संबंधी प्रश्नों में 1 kg जल मान लेना standard trick है।
• CHCl3 का मोलर द्रव्यमान 119.5 g mol−1 परीक्षा में सीधे पूछा जा सकता है।
Q.10 ऐल्कोहॉल तथा जल के एक विलयन में
आणविक अन्योन्यक्रिया की क्या भूमिका है?
उत्तर
ऐल्कोहॉल तथा जल के विलयन में ऐल्कोहॉल और जल के अणु
आपस में अंतराआणविक हाइड्रोजन बंध (Hydrogen bond) बनाते हैं।
परन्तु ये हाइड्रोजन बंध H2O–H2O तथा ऐल्कोहॉल–ऐल्कोहॉल हाइड्रोजन बंधों की तुलना में कमज़ोर होते हैं।
इस कारण अणुओं की वाष्प अवस्था में जाने की प्रवृत्ति बढ़ जाती है।
अतः यह विलयन राउल्ट के नियम से धनात्मक विचलन प्रदर्शित करता है।
व्याख्या
• जल के अणुओं के बीच H2O–H2O
हाइड्रोजन बंध उपस्थित होते हैं।• ऐल्कोहॉल के अणुओं के बीच ऐल्कोहॉल–ऐल्कोहॉल हाइड्रोजन बंध होते हैं।
• जब ऐल्कोहॉल और जल को मिलाया जाता है, तब ऐल्कोहॉल–जल के बीच नए हाइड्रोजन बंध बनते हैं।
• ये नए बने बंध:
– पहले से मौजूद H2O–H2O बंधों की तुलना में, तथा
– ऐल्कोहॉल–ऐल्कोहॉल बंधों की तुलना में कमज़ोर होते हैं।
• कमजोर अंतराआणविक बलों के कारण:
– ये अणु आसानी से वाष्प अवस्था में परिवर्तित हो जाते हैं,
– जिससे वाष्प दाब बढ़ जाता है तथा क्वथनांक कम हो जाता है।
• परिणामस्वरूप यह विलयन राउल्ट के नियम से धनात्मक विचलन प्रदर्शित करता है।
क्या आप जानते हैं?
• ऐल्कोहॉल–जल विलयन में हाइड्रोजन बॉन्डिंग मुख्य कारण है।• कमजोर अंतराआणविक बल → अधिक वाष्प दाब।
• अधिक वाष्प दाब → राउल्ट के नियम से धनात्मक विचलन।
• यह प्रश्न अक्सर “कारण बताइए” प्रकार में पूछा जाता है।
• परीक्षा में क्रम याद रखें:
कमज़ोर H-bond → अधिक वाष्प दाब → कम क्वथनांक → धनात्मक विचलन
Q.11 ताप बढ़ाने पर गैसों की द्रवों में विलेयता में
हमेशा कमी आने की प्रवृत्ति क्यों होती है?
उत्तर
गैस का द्रव में घुलना एक ऊष्माक्षेपी प्रक्रिया होती है।
ताप बढ़ाने पर संतुलन की स्थिति बाईं ओर विस्थापित हो जाती है
तथा विलयन से ऊष्मा मुक्त होती है।
परिणामस्वरूप गैस के अणु द्रव से बाहर निकलने लगते हैं और गैसों की द्रवों में विलेयता कम हो जाती है।
व्याख्या
Step 1: गैस का द्रव में घुलना• जब कोई गैस किसी द्रव में घुलती है, तो गैस के अणु द्रव के अणुओं के साथ अंतराआणविक आकर्षण बल बनाते हैं।
• इस प्रक्रिया में सामान्यतः ऊष्मा का उत्सर्जन होता है।
• अतः गैस का द्रव में घुलना एक ऊष्माक्षेपी प्रक्रिया कहलाती है।
Step 2: ताप बढ़ाने का प्रभाव
• ताप बढ़ाने पर विलयन को अतिरिक्त ऊष्मा मिलती है।
• ऊष्माक्षेपी प्रक्रिया में ताप बढ़ाने से संतुलन बाईं ओर खिसक जाता है।
• इसका अर्थ है कि द्रव में घुली गैस पुनः गैसीय अवस्था में जाने लगती है।
Step 3: विलेयता में कमी का कारण
• ताप बढ़ने से गैस के अणुओं की गतिज ऊर्जा बढ़ जाती है।
• बढ़ी हुई ऊर्जा के कारण गैस के अणु:
– द्रव में टिक नहीं पाते, तथा
– द्रव से बाहर निकल जाते हैं।
• इसलिए ताप बढ़ाने पर गैसों की द्रवों में विलेयता घट जाती है।
क्या आप जानते हैं?
• गैस का द्रव में घुलना एक ऊष्माक्षेपी प्रक्रिया है।• ताप बढ़ाने पर संतुलन बाईं ओर विस्थापित होता है।
• गर्म पेय में गैस कम घुली होती है, इसलिए ठंडा सोडा अधिक फिज़ करता है।
• यह प्रभाव Le Chatelier के सिद्धांत से समझाया जाता है।
• परीक्षा में key chain याद रखें:
ऊष्माक्षेपी प्रक्रिया → ताप वृद्धि → विलेयता में कमी
Q.12 हेनरी का नियम तथा इसके कुछ महत्वपूर्ण अनुप्रयोग लिखिए।
उत्तर
हेनरी का नियम (Henry’s Law):स्थिर ताप पर किसी द्रव में घुली गैस की मात्रा उस द्रव के ऊपर उपस्थित गैस के आंशिक दाब के समानुपाती होती है। इसे हेनरी का नियम कहते हैं।
व्याख्या
हेनरी का नियम:• सर्वप्रथम हेनरी ने गैस की द्रव में विलेयता और दाब के बीच मात्रात्मक संबंध प्रस्तुत किया।
• इस नियम के अनुसार:
स्थिर ताप पर, किसी विलायक के प्रति इकाई आयतन में घुली गैस का द्रव्यमान, विलयन के संपर्क में स्थित गैस के दाब के समानुपाती होता है।
मोल अंश के रूप में नियम:
यदि विलयन में घुली गैस की विलेयता को मोल अंश (X) से व्यक्त किया जाए, तो—
किसी गैस का वाष्प अवस्था में आंशिक दाब (p), विलयन में उस गैस के मोल अंश (X) के समानुपाती होता है।
अर्थात्,
p ∝ X
या
p = KH × X
जहाँ,
KH = हेनरी स्थिरांक
• जब एक से अधिक गैसों का मिश्रण किसी द्रव के संपर्क में होता है, तो प्रत्येक गैस अपने-अपने आंशिक दाब के अनुसार द्रव में घुलती है।
• इसलिए हेनरी का नियम प्रत्येक गैस पर स्वतंत्र रूप से लागू होता है।
हेनरी के नियम के महत्वपूर्ण अनुप्रयोग:
(1) सोडा जल एवं शीतल पेय
• सोडा जल और शीतल पेयों में CO2 की विलेयता बढ़ाने के लिए बोतलों को अधिक दाब पर बंद किया जाता है।
• अधिक दाब → अधिक CO2 घुली हुई
(2) गोताखोरों में बेंड्स रोग (Bends)
• गहरे समुद्र में अधिक बाहरी दाब के कारण गोताखोरों के रक्त में नाइट्रोजन की विलेयता बढ़ जाती है।
• जब गोताखोर तेजी से सतह की ओर आते हैं, तो बाहरी दाब अचानक कम हो जाता है, जिससे घुली हुई नाइट्रोजन बुलबुलों के रूप में बाहर निकल आती है।
• ये बुलबुले रक्त नलिकाओं में रुकावट उत्पन्न करते हैं, जिससे एक खतरनाक स्थिति उत्पन्न होती है, जिसे बेंड्स (Bends) कहते हैं।
• यह एक अत्यधिक पीड़ादायक एवं जानलेवा स्थिति हो सकती है।
• इससे बचने के लिए गोताखोरों के सिलेंडरों में हीलियम मिलाकर वायु भरी जाती है।
• इस मिश्रण की संरचना इस प्रकार होती है:
11.7% हीलियम, 56.2% नाइट्रोजन तथा 32.1% ऑक्सीजन
(3) अधिक ऊँचाई पर एनॉक्सिया (Anoxia)
• अधिक ऊँचाई वाले स्थानों पर ऑक्सीजन का आंशिक दाब कम होता है।
• इसके कारण रक्त और ऊतकों में ऑक्सीजन की विलेयता कम हो जाती है।
• परिणामस्वरूप व्यक्ति को:
– चक्कर आना
– कमजोरी
– स्पष्ट सोच में कठिनाई होती है।
• इस स्थिति को एनॉक्सिया कहते हैं।
क्या आप जानते हैं?
• हेनरी का नियम केवल
गैसों की द्रवों में विलेयता पर लागू होता है।• ताप का स्थिर होना इस नियम की अनिवार्य शर्त है।
• अधिक दाब → अधिक गैस घुली हुई।
• CO2, O2, N2 जैसे उदाहरण परीक्षा में बार-बार पूछे जाते हैं।
• याद रखने की ट्रिक:
दाब ↑ → विलेयता ↑ (गैसों के लिए)
Q.13 6.56 × 10−3 g एथेन युक्त एक संतृप्त विलयन में
एथेन का आंशिक दाब 1 bar है।
यदि विलयन में 5.00 × 10−2 g एथेन हो,
तो गैस का आंशिक दाब क्या होगा?
उत्तर
• गैस का आंशिक दाब = 7.62 bar (लगभग)
व्याख्या
दिया गया:एथेन का द्रव्यमान (m1) = 6.56 × 10−3 g
आंशिक दाब (P1) = 1 bar
एथेन का द्रव्यमान (m2) = 5.00 × 10−2 g
आंशिक दाब (P2) = ?
Step 1: हेनरी का नियम
स्थिर ताप पर, विलयन में घुली गैस की मात्रा उस गैस के आंशिक दाब के समानुपाती होती है।
अर्थात्,
आंशिक दाब ∝ गैस की मात्रा
m = KH × P
Step 2: Unitary method का उपयोग
| द्रव्यमान | आंशिक दाब |
|---|---|
| 6.56 × 10−3 g | 1 bar |
| 5.00 × 10−2 g | x |
अतः गुणा करके x का मान ज्ञात करेंगे:
x = (5.00 × 10−2 g / 6.56 × 10−3 g) × 1 bar
= 7.62 bar
क्या आप जानते हैं?
• ऐसे प्रश्नों में Unitary method का उपयोग
प्रश्न को और भी आसान बना देता है।• पहले और दूसरे केस में गैस वही होनी चाहिए।
• स्थिर ताप पर गैस की मात्रा ∝ आंशिक दाब।
• हेनरी का नियम केवल dilute / saturated विलयनों के लिए लागू होता है।
• परीक्षा में ट्रिक याद रखें:
ज़्यादा गैस घुली → ज़्यादा आंशिक दाब
कम गैस घुली → कम आंशिक दाब
Q.14 राउल्ट के नियम से धनात्मक तथा ऋणात्मक विचलन का क्या अर्थ है?
तथा मिश्रण के चिन्ह (ΔV, ΔH) का इन विचलनों से कैसे संबंध है?
उत्तर
• जब कोई विलयन राउल्ट के नियम द्वारा निर्धारित किए गए
वाष्प दाब से अधिक वाष्प दाब प्रदर्शित करता है,
तो उसे धनात्मक विचलन कहते हैं।• जब कोई विलयन राउल्ट के नियम द्वारा निर्धारित किए गए वाष्प दाब से कम वाष्प दाब प्रदर्शित करता है, तो उसे ऋणात्मक विचलन कहते हैं।
• धनात्मक विचलन में:
– ΔV > 0 (आयतन बढ़ता है)
– ΔH > 0 (ऊष्मा का अवशोषण होता है)
• ऋणात्मक विचलन में:
– ΔV < 0 (आयतन घटता है)
– ΔH < 0 (ऊष्मा का उत्सर्जन होता है)
व्याख्या
राउल्ट का नियम (संक्षेप में):राउल्ट के नियम के अनुसार, किसी आदर्श विलयन का वाष्प दाब उसमें उपस्थित प्रत्येक घटक के मोल अंश पर निर्भर करता है।
(A) धनात्मक विचलन (Positive Deviation)
अर्थ:
जब विलयन का वास्तविक (experimental) वाष्प दाब, राउल्ट के नियम से गणना किए गए वाष्प दाब से अधिक होता है।
कारण:
• A–B अंतराआणविक आकर्षण, A–A तथा B–B आकर्षण से कमज़ोर होता है।
परिणाम:
• अणु आसानी से वाष्प अवस्था में चले जाते हैं।
• वाष्प दाब बढ़ जाता है।
मिश्रण के चिन्ह:
• आयतन में वृद्धि → ΔV > 0
• ऊष्मा का अवशोषण → ΔH > 0
उदाहरण: एथेनॉल + जल
(B) ऋणात्मक विचलन (Negative Deviation)
अर्थ:
जब विलयन का वास्तविक (experimental) वाष्प दाब, राउल्ट के नियम से अपेक्षित वाष्प दाब से कम होता है।
कारण:
• A–B अंतराआणविक आकर्षण, A–A तथा B–B आकर्षण से अधिक मज़बूत होता है।
परिणाम:
• अणु वाष्प अवस्था में जाने से रुकते हैं।
• वाष्प दाब घट जाता है।
मिश्रण के चिन्ह:
• आयतन में कमी → ΔV < 0
• ऊष्मा का उत्सर्जन → ΔH < 0
उदाहरण: एसीटोन + क्लोरोफॉर्म
क्या आप जानते हैं?
• कमज़ोर A–B आकर्षण → अधिक वाष्प दाब → धनात्मक विचलन।• मज़बूत A–B आकर्षण → कम वाष्प दाब → ऋणात्मक विचलन।
• धनात्मक विचलन में: ΔV ↑ और ΔH ↑
• ऋणात्मक विचलन में: ΔV ↓ और ΔH ↓
Q.15 विलायक के सामान्य क्वथनांक पर,
एक अवाष्पशील विलेय के 2% जलीय विलयन का वाष्प दाब 1.004 bar है।
विलेय का मोलर द्रव्यमान क्या है?
उत्तर
• विलेय का मोलर द्रव्यमान = 40 g mol⁻¹ (लगभग)
व्याख्या
दिया गया:विलेय = अवाष्पशील
विलयन = 2% (w/w) जलीय विलयन
विलयन का वाष्प दाब (p) = 1.004 bar
विलायक (जल) का वाष्प दाब (सामान्य क्वथनांक पर) p0 = 1.013 bar
2% (w/w) का अर्थ:
100 g विलयन में:
• विलेय = 2 g
• जल (विलायक) = 98 g
जल का मोलर द्रव्यमान (M₁) = 18 g mol⁻¹
विलेय का मोलर द्रव्यमान = M₂ (ज्ञात करना है)
Step 1: राउल्ट के नियम का सूत्र (अवाष्पशील विलेय के लिए)
वाष्प दाब में सापेक्ष कमी = विलेय का मोल अंश
\( \frac{p^0 - p_s}{p^0} = \frac{n_1}{n_1 + n_2} \approx \frac{n_1}{n_2} \)
जहाँ
n₁ = विलेय के मोल
n₂ = विलायक (जल) के मोल
Step 2: मोल को द्रव्यमान के रूप में लिखना
\( \frac{p^0 - p_s}{p^0} = \frac{w_1 / M_2}{w_2 / M_1} \)
(क्योंकि n = w / M)
Step 3: संख्याएँ और units रखना
\( \frac{(1.013 - 1.004) bar}{1.013 \;bar} = \frac{2 g / M_2 }{98 g / 18 \text{g mol}^{-1}} \)
Step 4: समीकरण को हल करना
\( \frac{0.009 \; bar }{1.013 \; bar} = \frac{2 \; g \times 18 \;\text{g mol}^{-1}}{98 \; g \times M_2} \)
\( M_2 = \frac{2 \; g \times 18\;\text{g mol}^{-1} }{98 \;g} \times \frac{1.013 \;bar}{0.009 \; bar} \)
\( M_2 = 41.35 \; \text{g mol}^{-1}\)
\( M_2\approx 40 \; \text{g mol}^{-1} \)
क्या आप जानते हैं?
• अवाष्पशील विलेय के लिए वाष्प दाब में सापेक्ष कमी सीधे उपयोग की जाती है।• w/w प्रश्नों में 100 g विलयन मानना सबसे आसान ट्रिक है।
• dilute विलयन में n₁ / (n₁ + n₂) ≈ n₁ / n₂ होता है।
• सामान्य क्वथनांक पर जल का वाष्प दाब 1.013 bar होता है।
Q.16 हेप्टेन तथा ऑक्टेन एक आदर्श विलयन बनाते हैं।
373 K पर दोनों द्रव घटकों के वाष्प दाब क्रमशः
105.2 kPa तथा 46.8 kPa हैं।
26.0 g हेप्टेन तथा 35.0 g ऑक्टेन के मिश्रण का वाष्प दाब क्या होगा?
उत्तर
• मिश्रण का कुल वाष्प दाब = 73.08 kPa (लगभग)
व्याख्या
दिया गयाहेप्टेन का वाष्प दाब, phep° = 105.2 kPa
हेप्टेन का द्रव्यमान = 26.0 g
हेप्टेन का मोलर द्रव्यमान = 100 g mol⁻¹
ऑक्टेन का वाष्प दाब, poct° = 46.8 kPa
ऑक्टेन का द्रव्यमान = 35.0 g
ऑक्टेन का मोलर द्रव्यमान = 114 g mol⁻¹
Step 1: राउल्ट के नियम का सूत्र (इस तरीके से)
सूत्र: कुल वाष्प दाब = हेप्टेन का आंशिक वाष्प दाब + ऑक्टेन का आंशिक वाष्प दाब
\( P_T = P_{\text{Heptane}} + P_{\text{Octane}} \)
\( P_T = \left(p_{\text{Heptane}}^{\circ} \times X_{\text{Heptane}}\right)\) \(+ \left(p_{\text{Octane}}^{\circ} \times X_{\text{Octane}}\right) \)
\( P = \left( p_{\text{hep}}^{\circ} \times \frac{n_{\text{heptane}}} {n_{\text{heptane}} + n_{\text{octane}}} \right)\) \(+\) \(\left( p_{\text{oct}}^{\circ} \times \frac{n_{\text{octane}}} {n_{\text{heptane}} + n_{\text{octane}}} \right) \)
Step 2: हेप्टेन तथा ऑक्टेन के मोल लिखना
\( n_{\text{hep}} = \frac{26 \text{ g}}{100 \text{ g mol}^{-1}},\) \(\quad n_{\text{oct}} = \frac{35 \text{ g}}{114 \text{ g mol}^{-1}} \)
Step 3: सीधे मान रखना
\( P = 105.2 \times \frac{26/100}{(26/100 + 35/114)}\) \(+\) \(46.8 \times \frac{35/114}{(26/100 + 35/114)} \)
Step 4: गणना
\( P = 73.08 \text{ kPa} \)
क्या आप जानते हैं?
• आदर्श विलयन में राउल्ट का नियम सीधे लागू होता है।• मोल अंश निकालने के लिए द्रव्यमान/मोलर द्रव्यमान सबसे तेज़ तरीका है।
• दोनों आंशिक दाबों का योग = कुल वाष्प दाब।
• इस तरह के प्रश्नों में units अपने-आप cancel हो जाती हैं।
• Board exams में यह तरीका short और scoring माना जाता है।
Q.17: 300 K पर जल का वाष्प दाब 12.3 kPa है।
इसमें बने एक मोलल (1 molal) अवाष्पशील विलेय के विलयन का
वाष्प दाब ज्ञात कीजिए।
उत्तर
• विलयन का वाष्प दाब = 12.08 kPa (लगभग)
व्याख्या
दिया गयाताप = 300 K
शुद्ध जल का वाष्प दाब, p° = 12.3 kPa
विलयन = 1 मोलल अवाष्पशील विलेय का विलयन
Step 1: 1 मोलल विलयन का अर्थ
1 kg जल (विलायक) में, विलेय के मोल (nA) = 1 mol
Step 2: जल और विलेय के मोल
जल का मोलर द्रव्यमान = 18 g mol⁻¹
1 kg जल = 1000 g
अतः जल के मोल (nB) = द्रव्यमान ÷ मोलर द्रव्यमान
\( n_B = \frac{1000}{18} \)
जल के मोल (nB) = 55.5 mol
विलेय के मोल (nA) = 1 mol
कुल मोल = nA + nB = (1 + 55.5) mol
Step 3: विलेय का मोल अंश निकालना
सूत्र: मोल अंश = घटक के मोल / कुल मोल
\( x_A = \frac{1}{1 + 55.5} \)
\( x_A = 0.0177 \)
Step 4: राउल्ट के नियम का प्रयोग
अवाष्पशील विलेय के लिए: वाष्प दाब में सापेक्ष कमी = विलेय का मोल अंश
\( \frac{p^\circ - p_s}{p^\circ} = x_A \)
Step 5: मान रखना
\( \frac{12.3 - p_s}{12.3} = 0.0177 \)
Step 6: विलयन का वाष्प दाब निकालना
\( 12.3 - p_s = 12.3 \times 0.0177 \)
\( 12.3 - p_s = 0.218 \)
\( p_s = 12.3 - 0.218 \)
\( p_s = 12.08 \text{ kPa} \)
क्या आप जानते हैं?
• 1 मोलल विलयन में 1 kg जल लेना standard तरीका है।• अवाष्पशील विलेय के लिए (p° − ps) / p° = xA।
• जल के मोल = 55.5 mol per kg याद रखना बहुत उपयोगी है।
• मोललता आधारित प्रश्नों में ताप का असर नहीं पड़ता।
Q.18: 114 g ऑक्टेन में किसी अवाष्पशील विलेय
(मोलर द्रव्यमान = 40 g mol⁻¹) की कितनी मात्रा घोली जाए
कि ऑक्टेन का वाष्प दाब घटकर मूल का 80% रह जाए?
उत्तर
• घोले जाने वाले अवाष्पशील विलेय की मात्रा = 8 g
व्याख्या
दिया गयाविलेय का द्रव्यमान (wA) = ?
विलेय का मोलर द्रव्यमान (MA) = 40 g mol⁻¹
विलायक (ऑक्टेन) का द्रव्यमान (wB) = 114 g
विलायक (ऑक्टेन) का मोलर द्रव्यमान (MB) = 114 g mol⁻¹
वाष्प दाब घटकर प्रारम्भिक का 80% रह जाता है
अर्थात
\( \frac{p_s}{p^\circ} = 0.80 \)
Step 1: राउल्ट के नियम का सूत्र (अवाष्पशील विलेय के लिए)
सूत्र (हिंदी में): वाष्प दाब में सापेक्ष कमी = विलेय का मोल अंश
\( \frac{p^\circ - p_s}{p^\circ} = \frac{w_A}{M_A} \times \frac{M_B}{w_B} \)
Step 2: मान रखना
\( \frac{100 - 80}{100} = \frac{w_A}{40 \; \text{g mol}^{-1}} \times \frac{114 \; \text{g mol}^{-1} }{114\; g} \)
Step 3: गणना
\( 0.20 = \frac{w_A}{40 \; g} \)
\( w_A = 8 \text{ g} \)
क्या आप जानते हैं?
• ऐसे प्रश्नों में वाष्प दाब में सापेक्ष कमी सबसे पहले निकालो।• अवाष्पशील विलेय के लिए राउल्ट का नियम सीधे लागू होता है।
• w/w या द्रव्यमान आधारित प्रश्नों में moles में जाने की ज़रूरत नहीं होती।
• ट्रिक याद रखें: जितना ज़्यादा विलेय → उतनी ज़्यादा वाष्प दाब में कमी।
Q.19 एक विलयन, जिसमें एक अवाष्पशील ठोस के 30 g को
90 g जल में घोलकर बनाया गया है, उसका 298 K पर वाष्प दाब
2.8 kPa है। विलयन में 18 g जल और मिलाया जाता है, जिससे
नया वाष्प दाब 298 K पर 2.9 kPa हो जाता है।
निम्नलिखित की गणना कीजिए— (i) विलेय का मोलर द्रव्यमान (ii) 298 K पर जल का वाष्प दाब
निम्नलिखित की गणना कीजिए— (i) विलेय का मोलर द्रव्यमान (ii) 298 K पर जल का वाष्प दाब
उत्तर
(i) विलेय का मोलर द्रव्यमान = 23 g mol⁻¹(ii) 298 K पर जल का वाष्प दाब = 3.5 kPa
व्याख्या
दिया गयाप्रथम अवस्था (I):
विलेय का द्रव्यमान (wA) = 30 g
विलेय का मोलर द्रव्यमान = MA (ज्ञात करना है)
जल का द्रव्यमान (wB) = 90 g
जल का मोलर द्रव्यमान (MB) = 18 g mol⁻¹
विलयन का वाष्प दाब (ps1) = 2.8 kPa
द्वितीय अवस्था (II):
अतिरिक्त जल = 18 g
कुल जल = 90 + 18 = 108 g
नया वाष्प दाब (ps2) = 2.9 kPa
शुद्ध जल का वाष्प दाब = p° (ज्ञात करना है)
Step 1: अवाष्पशील विलेय के लिए राउल्ट का नियम
सूत्र: वाष्प दाब में सापेक्ष वृद्धि (इस रूप में प्रयुक्त)
\( \frac{p^\circ - p_s}{p_s} = \frac{w_A}{M_A} \times \frac{M_B}{w_B} \)
Step 2: प्रथम अवस्था के लिए समीकरण (I)
\( \frac{p^\circ - 2.8\; \text{kPa}}{2.8\; \text{kPa}} = \frac{30\; g}{M_A} \times \frac{18\; \text{g mol}^{-1}}{90\; g} \)
\( \frac{p^\circ - 2.8}{2.8} = \frac{6}{M_A} \) …(i)
Step 3: द्वितीय अवस्था के लिए समीकरण (II)
\( \frac{p^\circ - 2.9\; \text{kPa}}{2.9\; \text{kPa}} = \frac{30\; g}{M_A} \times \frac{18\; \text{g mol}^{-1}}{108\; g} \)
\( \frac{p^\circ - 2.9}{2.9} = \frac{5}{M_A} \) …(ii)
Step 4: समीकरण (i) और (ii) को हल करना
दोनों समीकरणों को हल करने पर प्राप्त होता है—
\( \frac{p^\circ - 2.8}{2.8} = \frac{6}{M_A} \) …(i) , \( \frac{p^\circ - 2.9}{2.9} = \frac{5}{M_A} \) …(ii)
\( p^\circ = 3.5\; \text{kPa} \)
\( M_A = 23\; \text{g mol}^{-1} \)
क्या आप जानते हैं?
• ऐसे प्रश्नों में दो अवस्थाओं के वाष्प दाब दिए होते हैं, जिससे दो समीकरण बनते हैं।• अवाष्पशील विलेय के लिए राउल्ट का नियम सबसे महत्वपूर्ण होता है।
• जल का मोलर द्रव्यमान 18 g mol⁻¹ हर बार प्रयोग होगा।
• पहले formula लिखो, फिर values रखो, फिर simultaneous equations हल करो।
• LaTeX में units दिखाने के लिए \; g , \text{g mol}^{-1} का प्रयोग करो।
Q.20 शक्कर के 5% (द्रव्यमान) जलीय विलयन का हिमांक 271 K है।
यदि शुद्ध जल का हिमांक 273.15 K है, तो ग्लूकोज के 5%
जलीय विलयन का हिमांक ज्ञात कीजिए।
उत्तर
• ग्लूकोज के 5% (w/w) जलीय विलयन का हिमांक = 269.06 K (लगभग)
व्याख्या
दिया गयाशक्कर (Sucrose) का 5% (w/w) विलयन
शक्कर विलयन का हिमांक = 271 K
शुद्ध जल का हिमांक (T0f) = 273.15 K
ग्लूकोज का मोलर द्रव्यमान (MGlucose) = 180 g mol⁻¹
शक्कर (सुक्रोज) का मोलर द्रव्यमान (MSucrose) = 342 g mol⁻¹
Step 1: शक्कर विलयन के लिए हिमांक अवनमन निकालना
सूत्र : हिमांक अवनमन = शुद्ध विलायक का हिमांक − विलयन का हिमांक
\( \Delta T_f = T^0_f - T_f \)
\( \Delta T_f = 273.15\ \text{K} - 271\ \text{K} \)
\( \Delta T_f = 2.15\ \text{K} \)
Step 2: दोनों विलयनों की सांद्रता समान है, अतः 5% (w/w) विलयन का अर्थ है, 100 g विलयन में
• विलेय, शक्कर (सुक्रोज) अथवा ग्लूकोज = 5 g
• जल (विलायक) = 95 g
Step 3: सबसे पहले हम हिमांक अवनमन के सूत्र से Kf का मान ज्ञात करते हैं।
सूत्र:
\( \Delta T_f = K_f \times m \)
\( \Delta T_f = K_f \times \frac{w_A(g)\times1000\ g}{M_A(g\ {\rm mol}^{-1}) \times w_B(g)\times1\ kg} \)
\( K_f = \frac{\Delta T_f \times M_A(g\ {\rm mol}^{-1}) \times w_B(g)\times1\ kg}{w_A(g)\times1000\ g} \)
\( K_f = \frac{2.15\ \text{K} \times 342\ \text{g mol}^{-1} \times 95\ \text{g}\times1\ \text{kg}}{5\ \text{g}\times1000\ \text{g}} \)
\( K_f \approx 14\ \text{K kg mol}^{-1} \)
Step 4: ग्लूकोज के लिए समीकरण बनाना
\( \Delta T_f = K_f \times \frac{w_A(g)\times1000\ g}{M_A(g\ {\rm mol}^{-1}) \times w_B(g)\times1\ kg} \)
\( \Delta T_f = 14\ \text{K kg mol}^{-1} \times \frac{5\ \text{g}\times1000\ \text{g}}{180\ \text{g mol}^{-1}\times95\ \text{g}\times1\ \text{kg}} \)
\( \Delta T_f = 4.1\ \text{K} \)
Step 5: ग्लूकोज विलयन का हिमांक निकालना
सूत्र : विलयन का हिमांक = शुद्ध जल का हिमांक − हिमांक अवनमन
\( \Delta T_f = T^0_f - T_f \)
\( T_f = 273.15\ \text{K} - 4.1\ \text{K} = 269.05\ \text{K} \)
क्या आप जानते हैं?
• समान % (w/w) पर कम मोलर द्रव्यमान → अधिक हिमांक अवनमन।• हिमांक अवनमन एक सांख्यिक गुण है, पदार्थ की प्रकृति पर निर्भर नहीं करता।
• 5% (w/w) में हमेशा 100 g विलयन मानना आसान ट्रिक है।
• शक्कर (342) और ग्लूकोज (180) का मोलर द्रव्यमान तुलना के लिए बहुत पूछा जाता है।
• परीक्षा ट्रिक: ΔT ∝ 1 / मोलर द्रव्यमान
Q.21 दो तत्व A तथा B मिलकर AB₂ तथा AB₄ सूत्र वाले दो यौगिक बनाते हैं।
20 g बेंज़ीन में घोलने पर 1 g AB₂ हिमांक को 2.3 K अवनत करता है,
जबकि 1.0 g AB₄ से 1.3 K का अवनमन होता है।
बेंज़ीन के लिए मोलर हिमांक अवनमन स्थिरांक
5.1 K kg mol⁻¹ है।
A तथा B के परमाण्वीय द्रव्यमान ज्ञात कीजिए।
उत्तर
• तत्व A का परमाण्वीय द्रव्यमान = 25.59 u (लगभग)• तत्व B का परमाण्वीय द्रव्यमान = 42.64 u (लगभग)
व्याख्या
दिया गया
विलेय का द्रव्यमान (wA) = 1 g
विलायक = बेंज़ीन
विलायक का द्रव्यमान (wB) = 20 g
AB₂ के लिए हिमांक अवनमन, ΔTf = 2.3 K
AB₄ के लिए हिमांक अवनमन, ΔTf = 1.3 K
बेंज़ीन के लिए
Kf = 5.1 K kg mol⁻¹
मान लें—
A का परमाण्वीय द्रव्यमान = a
B का परमाण्वीय द्रव्यमान = b
तो,
AB₂ का मोलर द्रव्यमान = a + 2b
AB₄ का मोलर द्रव्यमान = a + 4b
Step 1: हिमांक अवनमन का सूत्र
सूत्र : हिमांक अवनमन
\( \Delta T_f = K_f \times \frac{w_A(g)\times1000\ g}{M_A(g\ {\rm mol}^{-1}) \times w_B(g)\times1\ kg} \)
Step 2: AB₂ के लिए समीकरण बनाना
\( 2.3\ K = 5.1\ K\ kg\ {\rm mol}^{-1} \times \frac{1\ g \times 1000\ g}{(a+2b)\ g\ {\rm mol}^{-1} \times 20\ g \times 1\ kg} \)
a + 2b = 110.87 g mol⁻¹ …(i)
Step 3: AB₄ के लिए समीकरण बनाना
\( 1.3\ K = 5.1\ K\ kg\ {\rm mol}^{-1} \times \frac{1\ g \times 1000\ g}{(a+4b)\ g\ {\rm mol}^{-1} \times 20\ g \times 1\ kg} \)
a + 4b = 196.15 g mol⁻¹ …(ii)
Step 4: अब दोनों समीकरणों को हल करते हैं
दिए गए समीकरण:
a + 2b = 110.87 …(i)
a + 4b = 196.15 …(ii)
Step 5: (ii) − (i)
\( (a+4b)-(a+2b)=196.15-110.87 \)
\( 2b = 85.28 \)
\( b = 42.64\ g\ {\rm mol}^{-1} \)
Step 6: b का मान (i) में रखें
\( a + 2(42.64) = 110.87 \)
\( a + 85.28 = 110.87 \)
\( a = 25.59\ g\ {\rm mol}^{-1} \)
Final Answer:
A का परमाणु द्रव्यमान (a) = 25.6 g mol⁻¹
B का परमाणु द्रव्यमान (b) = 42.6 g mol⁻¹
क्या आप जानते हैं?
• समान द्रव्यमान और समान विलायक में ΔTf ∝ 1 / मोलर द्रव्यमान।• AB₂ और AB₄ जैसे प्रश्नों में परमाण्वीय द्रव्यमान मानकर समीकरण बनाना सबसे आसान तरीका है।
• हिमांक अवनमन एक सांख्यिक गुण है, आयनन नहीं दिया हो तो i = 1 मानते हैं।
• ऐसे प्रश्नों में अक्सर दो समीकरण बनाकर simultaneous solution पूछा जाता है।
• परीक्षा ट्रिक: कम ΔTf ⇒ बड़ा मोलर द्रव्यमान।
Q.22: 300 K पर 36 g प्रति लीटर सांद्रता वाले ग्लूकोज के विलयन का
परासरण दाब 4.98 bar है। यदि इसी ताप पर विलयन का परासरण दाब
1.52 bar हो, तो उसकी सांद्रता क्या होगी?
उत्तर
• विलयन की सांद्रता = 11 g L⁻¹ (लगभग)
व्याख्या
दिया गया
ताप = 300 K (स्थिर)
प्रथम विलयन के लिए
• सांद्रता (C₁) = 36 g L⁻¹
• परासरण दाब (π₁) = 4.98 bar
द्वितीय विलयन के लिए
• परासरण दाब (π₂) = 1.52 bar
• सांद्रता (C₂) = ?
Step 1: सिद्धांत (परासरण दाब और सांद्रता का संबंध)
सिद्धांत: स्थिर ताप पर, किसी विलयन का परासरण दाब उसकी सांद्रता के समानुपाती होता है।
अर्थात
\( \pi \propto C \)
Step 2: समानुपात का सूत्र लिखना
\( \frac{\pi_1}{\pi_2} = \frac{C_1}{C_2} \)
Step 3: मान रखना (units के साथ)
\( \frac{4.98\; \text{bar}}{1.52\; \text{bar}} = \frac{36\; \text{g L}^{-1}}{C_2} \)
Step 4: सांद्रता निकालना
\( C_2 = \frac{36 \times 1.52}{4.98} \)
\( C_2 = 10.98\; \text{g L}^{-1} \)
\( \boxed{C_2 \approx 11\; \text{g L}^{-1}} \)
क्या आप जानते हैं?
• स्थिर ताप पर परासरण दाब ∝ सांद्रता।• ऐसे प्रश्नों में मोलर द्रव्यमान की आवश्यकता नहीं होती।
• यह नियम केवल अवाष्पशील विलेय के लिए सही होता है।
• पहले और दूसरे विलयन में विलेय एक ही होना चाहिए।
• परीक्षा ट्रिक:
कम परासरण दाब → कम सांद्रता
Q.23 निम्नलिखित युग्मों में उपस्थित सबसे महत्वपूर्ण
अंतराआणविक आकर्षण बलों का सुझाव दीजिए।
उत्तर
(i) n-हेक्सेन तथा n-ऑक्टेन → लंदन अपसारी बल (London dispersion forces)(ii) I₂ तथा CCl₄ → लंदन अपसारी बल (London dispersion forces)
(iii) NaClO₄ तथा H₂O → आयन–डाइपोल आकर्षण बल (Ion–dipole forces)
(iv) मेथेनॉल तथा एसीटोन → हाइड्रोजन बंध (Hydrogen bonding)
(v) एसीटोनाइट्राइल (CH₃CN) तथा एसीटोन (C₃H₆O) → डाइपोल–डाइपोल आकर्षण बल (Dipole–dipole forces)
व्याख्या
(i) n-हेक्सेन तथा n-ऑक्टेन• दोनों अणु अध्रुवीय (non-polar) हैं।
• इनमें कोई स्थायी डाइपोल या आयन नहीं होता।
• इसलिए इनके बीच केवल लंदन अपसारी बल कार्य करते हैं।
(ii) I₂ तथा CCl₄
• I₂ और CCl₄ दोनों अध्रुवीय अणु हैं।
• इनके बीच भी केवल क्षणिक डाइपोल उत्पन्न होते हैं।
• अतः प्रमुख बल लंदन अपसारी बल होता है।
(iii) NaClO₄ तथा H₂O
• NaClO₄ एक आयनिक यौगिक है।
• जल एक ध्रुवीय अणु है।
• आयन और ध्रुवीय अणु के बीच आयन–डाइपोल आकर्षण बल उत्पन्न होता है।
(iv) मेथेनॉल तथा एसीटोन
• मेथेनॉल में –OH समूह उपस्थित होता है।
• एसीटोन में C=O समूह होता है।
• –OH के H और C=O के O के बीच हाइड्रोजन बंध बनता है।
• इसलिए प्रमुख आकर्षण बल हाइड्रोजन बंध है।
(v) एसीटोनाइट्राइल (CH₃CN) तथा एसीटोन (C₃H₆O)
• दोनों अणु ध्रुवीय हैं।
• लेकिन इनमें H–O या H–N जैसा समूह नहीं है।
• अतः इनके बीच डाइपोल–डाइपोल आकर्षण बल प्रमुख होता है।
क्या आप जानते हैं?
• अध्रुवीय–अध्रुवीय → London dispersion forces• आयन–ध्रुवीय अणु → Ion–dipole forces
• –OH या –NH उपस्थित हो → Hydrogen bonding
• ध्रुवीय–ध्रुवीय (बिना H-bond) → Dipole–dipole forces
• परीक्षा ट्रिक: पहले polarity देखो, फिर functional group पहचानो
Q.24 विलेय–विलायक आकर्षण के आधार पर निम्नलिखित को n-ऑक्टेन में विलेयता के बढ़ते क्रम में व्यवस्थित कीजिए—
KCl, CH₃OH, CH₃CN, साइक्लोहेक्सेन।
उत्तर
n-ऑक्टेन में विलेयता का बढ़ता क्रम:KCl < CH₃OH < CH₃CN < साइक्लोहेक्सेन
व्याख्या
n-ऑक्टेन एक अध्रुवीय (non-polar) विलायक है।अतः इसमें वे विलेय अधिक घुलते हैं जिनकी प्रकृति भी अध्रुवीय हो या जिनमें अध्रुवीय भाग प्रमुख हो।
KCl
• KCl एक आयनिक यौगिक है।
• आयनिक यौगिक अध्रुवीय विलायकों में लगभग नहीं घुलते।
• इसलिए n-ऑक्टेन में इसकी विलेयता सबसे कम होती है।
CH₃OH (मेथेनॉल)
• मेथेनॉल एक ध्रुवीय अणु है।
• इसमें –OH समूह के कारण मजबूत अंतराआणविक आकर्षण होते हैं।
• अध्रुवीय n-ऑक्टेन में इसकी विलेयता कम होती है,
परंतु KCl से अधिक होती है।
CH₃CN (एसीटोनाइट्राइल)
• CH₃CN ध्रुवीय है, लेकिन मेथेनॉल की तुलना में कम ध्रुवीय होता है।
• इसलिए n-ऑक्टेन में इसकी विलेयता
CH₃OH से अधिक होती है।
साइक्लोहेक्सेन
• साइक्लोहेक्सेन एक अध्रुवीय हाइड्रोकार्बन है।
• “Like dissolves like” सिद्धांत के अनुसार
अध्रुवीय विलेय अध्रुवीय विलायक में आसानी से घुलता है।
• अतः n-ऑक्टेन में इसकी विलेयता सबसे अधिक होती है।
क्या आप जानते हैं?
• Like dissolves like — यही सबसे महत्वपूर्ण नियम है• आयनिक यौगिक → अध्रुवीय विलायक में लगभग अघुलनशील
• ध्रुवीयता जितनी कम → n-ऑक्टेन में विलेयता उतनी अधिक
• अध्रुवीय हाइड्रोकार्बन → अध्रुवीय विलायक में सर्वाधिक घुलनशील
• परीक्षा ट्रिक: Ionic < Polar < Less-polar < Non-polar
Q.25 पहचानिए कि निम्नलिखित यौगिकों में से कौन-कौन जल में अत्यधिक विलेय, आंशिक रूप से विलेय तथा अविलेय हैं—
(i) फिनॉल (ii) टॉल्यूइन (iii) फॉर्मिक अम्ल
(iv) एथिलीन ग्लाइकोल (v) क्लोरोफॉर्म (vi) पेंटानॉल
(i) फिनॉल (ii) टॉल्यूइन (iii) फॉर्मिक अम्ल
(iv) एथिलीन ग्लाइकोल (v) क्लोरोफॉर्म (vi) पेंटानॉल
उत्तर
जल में अत्यधिक विलेय (Highly soluble in water)• फॉर्मिक अम्ल
• एथिलीन ग्लाइकोल
जल में आंशिक रूप से विलेय (Partially soluble in water)
• फिनॉल
• पेंटानॉल
जल में अविलेय (Insoluble in water)
• टॉल्यूइन
• क्लोरोफॉर्म
व्याख्या
जल एक ध्रुवीय विलायक है।जल में किसी यौगिक की विलेयता मुख्यतः इन बातों पर निर्भर करती है—
• यौगिक की ध्रुवीयता
• हाइड्रोजन बॉन्डिंग की क्षमता
• हाइड्रोकार्बन भाग का आकार
(i) फिनॉल
• फिनॉल में –OH समूह होता है, जिससे जल के साथ हाइड्रोजन बॉन्ड बनता है।
• लेकिन बेंजीन रिंग अध्रुवीय होती है।
• इसलिए फिनॉल आंशिक रूप से विलेय होता है।
(ii) टॉल्यूइन
• टॉल्यूइन एक अध्रुवीय हाइड्रोकार्बन है।
• इसमें हाइड्रोजन बॉन्डिंग की क्षमता नहीं होती।
• इसलिए यह जल में अविलेय होता है।
(iii) फॉर्मिक अम्ल
• यह एक छोटा, अत्यधिक ध्रुवीय कार्बोक्सिलिक अम्ल है।
• जल के साथ मजबूत हाइड्रोजन बॉन्ड बनाता है।
• इसलिए जल में अत्यधिक विलेय होता है।
(iv) एथिलीन ग्लाइकोल
• इसमें दो –OH समूह होते हैं।
• जल के साथ बहुत मजबूत हाइड्रोजन बॉन्डिंग होती है।
• इसलिए यह जल में अत्यधिक विलेय होता है।
(v) क्लोरोफॉर्म
• क्लोरोफॉर्म लगभग अध्रुवीय होता है।
• जल के साथ प्रभावी हाइड्रोजन बॉन्ड नहीं बनाता।
• इसलिए जल में अविलेय माना जाता है।
(vi) पेंटानॉल
• इसमें –OH समूह है, लेकिन
• लंबी हाइड्रोकार्बन श्रृंखला विलेयता कम कर देती है।
• इसलिए यह जल में आंशिक रूप से विलेय होता है।
क्या आप जानते हैं?
• –OH और –COOH समूह → जल में विलेयता बढ़ाते हैं• हाइड्रोकार्बन श्रृंखला जितनी लंबी → विलेयता उतनी कम
• एक से अधिक –OH समूह → अत्यधिक विलेयता
• अध्रुवीय यौगिक → जल में अविलेय
• परीक्षा ट्रिक:
Polar + H-bonding = Soluble in water
Q.26 यदि किसी झील के जल का घनत्व 1.25 g mL⁻¹ है तथा उसमें
92 g Na⁺ आयन प्रति किलोग्राम जल में उपस्थित हैं,
तो झील में Na⁺ आयन की मोलरता ज्ञात कीजिए।
उत्तर
Na⁺ आयन की मोलरता = 4.58 mol L⁻¹ (लगभग)
व्याख्या
दिया गयाजल का घनत्व = 1.25 g mL⁻¹
Na⁺ आयन का द्रव्यमान = 92 g प्रति kg जल
Na का मोलर द्रव्यमान = 23 g mol⁻¹
Step 1: Na⁺ आयन के मोल निकालना
सूत्र : मोल = द्रव्यमान / मोलर द्रव्यमान
Na⁺ के मोल = \( \frac{92\ \text{g}}{23\ \text{g mol}^{-1}} = 4\ \text{mol} \)
Step 2: विलयन का कुल द्रव्यमान निकालना
1 kg जल = 1000 g
कुल विलयन का द्रव्यमान = जल का द्रव्यमान + Na⁺ का द्रव्यमान
= 1000 g + 92 g
= 1092 g
Step 3: विलयन का आयतन निकालना
सूत्र: घनत्व = द्रव्यमान / आयतन
आयतन = द्रव्यमान / घनत्व
आयतन = \( \frac{1092\ \text{g}}{1.25\ \text{g mL}^{-1}} = 873.6\ \text{mL} \)
= 0.8736 L
Step 4: मोलरता की गणना
सूत्र: मोलरता = विलेय के मोल / विलयन का आयतन (लीटर में)
मोलरता = \( \frac{4\ \text{mol}}{0.8736\ \text{L}} = 4.58\ \text{mol L}^{-1} \)
क्या आप जानते हैं?
• पहले मोल निकालो, फिर आयतन• घनत्व दिया हो तो मोलरता हमेशा निकाली जा सकती है
• “प्रति kg जल” दिया हो तो पहले कुल विलयन का द्रव्यमान बनाओ
• Na⁺ का मोलर द्रव्यमान 23 g mol⁻¹ हमेशा याद रखो
• परीक्षा ट्रिक: Mass → Moles → Volume → Molarity
Q.27 यदि CuS का विलेयता गुणनफल (Ksp) = 6 × 10⁻¹⁶ है,
तो जलीय विलयन में उसकी अधिकतम मोलरता ज्ञात कीजिए।
उत्तर
CuS की अधिकतम मोलरता = 2.45 × 10⁻⁸ mol L⁻¹
व्याख्या
दिया गयाCuS का विलेयता गुणनफल, Ksp = 6 × 10⁻¹⁶
Step 1: आयनीकरण समीकरण लिखना
CuS (s) ⇌ Cu²⁺ (aq) + S²⁻ (aq)
मान लेते हैं कि CuS की विलेयता = s mol L⁻¹
तब, [Cu²⁺] = s तथा [S²⁻] = s
Step 2: Ksp का व्यंजक लिखना
सूत्र: Ksp = [Cu²⁺][S²⁻]
\( K_{sp} = s \times s = s^2 \)
Step 3: मान रखना
\( 6 \times 10^{-16} = s^2 \)
Step 4: s निकालना
\( s = \sqrt{6 \times 10^{-16}} \)
\( s = 2.45 \times 10^{-8}\ \text{mol L}^{-1} \)
क्या आप जानते हैं?
• 1 : 1 इलेक्ट्रोलाइट के लिए Ksp = s²• अधिकतम मोलरता = विलेयता (s)
• बहुत कम Ksp → बहुत कम विलेयता
• ऐसे प्रश्नों में मोलर द्रव्यमान की आवश्यकता नहीं होती
• परीक्षा ट्रिक: पहले आयनीकरण, फिर Ksp expression, फिर square root
Q.28 जब 6.5 g एस्पिरिन (C₉H₈O₄) को 450 g एसीटोनाइट्राइल (CH₃CN) में घोला जाए,
तो एसीटोनाइट्राइल में एस्पिरिन का भार प्रतिशत ज्ञात कीजिए।
उत्तर
एसीटोनाइट्राइल में एस्पिरिन का भार प्रतिशत =
1.42% (लगभग)
व्याख्या
दिया गयाविलेय (एस्पिरिन) का द्रव्यमान = 6.5 g
विलायक (एसीटोनाइट्राइल) का द्रव्यमान = 450 g
Step 1: विलयन का कुल द्रव्यमान निकालना
सूत्र : कुल द्रव्यमान = विलेय का द्रव्यमान + विलायक का द्रव्यमान
कुल द्रव्यमान = 6.5 g + 450 g = 456.5 g
Step 2: भार प्रतिशत का सूत्र लगाना
सूत्र : भार प्रतिशत = (विलेय का द्रव्यमान / विलयन का कुल द्रव्यमान) × 100
भार प्रतिशत = \( \frac{6.5\ \text{g}}{456.5\ \text{g}} \times 100 = 1.42\% \ \text{w/w} \)
क्या आप जानते हैं?
👉 Aspirin (एस्पिरिन) का रासायनिक नाम Acetyl Salicylic Acid है और यह सबसे ज़्यादा इस्तेमाल होने वाली pain relief दवाओं में से एक है।👉 भार प्रतिशत (w/w %) में केवल द्रव्यमान (mass) का प्रयोग होता है
👉 ऐसे प्रश्नों में मोलर द्रव्यमान निकालना ज़रूरी नहीं होता
👉 हमेशा सबसे पहले कुल विलयन का द्रव्यमान निकालो
👉 % (w/w) वाले प्रश्नों में सरल अनुपात (ratio method) से जल्दी उत्तर निकलता है
👉 Aspirin जैसे ठोस, अवाष्पशील विलेय के लिए हिमांक अवनमन सीधे विलेय की मात्रा पर निर्भर करता है, nature पर नहीं
👉 परीक्षा ट्रिक: %w/w = (विलेय का द्रव्यमान / कुल विलयन का द्रव्यमान) × 100
Q.29 नैलार्फीन (C₁₉H₂₁NO₃), जो कि मॉर्फिन जैसी होती है, का उपयोग नशीली दवाओं के उपभोक्ताओं द्वारा नशीली दवा छोड़ने से उत्पन्न लक्षणों को दूर करने में किया जाता है। सामान्यतः नैलार्फीन की 1.5 mg खुराक दी जाती है। उपरोक्त खुराक के लिए 1.5 × 10⁻³ m जलीय विलयन का कितना द्रव्यमान आवश्यक होगा?
उत्तर
आवश्यक जलीय विलयन का द्रव्यमान =
3.216 g (लगभग)
व्याख्या
दिया गयाविलेय (नैलार्फीन) का द्रव्यमान (wA) = 1.5 mg = 0.0015 g
विलेय (नैलार्फीन) का मोलर द्रव्यमान (MA) = 311 g mol⁻¹
विलयन की मोललता (m) = 1.5 × 10⁻³ m
Step 1: मोललता का सूत्र लिखना
सूत्र : मोललता (m) = विलेय के मोल / विलायक का द्रव्यमान (kg में)
\( m=\frac{n_A\;(\mathrm{mol})}{w_B\;(\mathrm{kg})} \)
\( m=\frac{w_A\;(\mathrm{g})} {M_A\;(\mathrm{g\,mol}^{-1}) \times w_B\;(\mathrm{kg})} \)
\( m=\frac{w_A\;(\mathrm{g}) \times 1000\,\mathrm{g}} {M_A\;(\mathrm{g\,mol}^{-1}) \times w_B\;(\mathrm{g}) \times 1\,\mathrm{kg}} \)
जहाँ, m = मोललता
wB = विलायक (जल) का द्रव्यमान (g में)
Step 2: मान रखना
\( 1.5\times 10^{-3}\, m \; (\text{or mol kg}^{-1}) = \frac{0.0015\,\mathrm{g}}{311\,\mathrm{g\,mol}^{-1}} \times \frac{1000\,\mathrm{g}}{w_B\,(\mathrm{g}) \times 1\,\mathrm{kg}} \)
Step 3: wB (जल का द्रव्यमान) निकालना
\( w_B = \frac{0.0015\,\mathrm{g}}{311\,\mathrm{g\,mol}^{-1}} \times \frac{1000\,\mathrm{g}} {1.5\times 10^{-3}\,\mathrm{mol\,kg}^{-1}\times 1\,\mathrm{kg}} \)
\( w_B = 3.2154\ \text{g} \)
Step 4: विलयन का कुल द्रव्यमान निकालना
सूत्र: विलयन का द्रव्यमान = विलेय का द्रव्यमान + विलायक का द्रव्यमान
विलयन का द्रव्यमान = 0.0015 g + 3.2154 g
= 3.2169 g
≈ 3.216 g
क्या आप जानते हैं?
👉 मोललता में हमेशा विलायक का द्रव्यमान (kg में) लिया जाता है👉 mg को g में बदलना सबसे पहली और ज़रूरी step है
👉 बहुत dilute विलयनों में विलयन का द्रव्यमान ≈ विलायक का द्रव्यमान
👉 ऐसे प्रश्नों में मोलरता की ज़रूरत नहीं होती
👉 परीक्षा ट्रिक: पहले m का formula लिखो, फिर unit conversion करो
Q.30 बेंज़ोइक अम्ल का मेथेनॉल में 0.15 m विलयन बनाने के लिए आवश्यक मात्रा की गणना कीजिए।
उत्तर
आवश्यक बेंज़ोइक अम्ल की मात्रा =
18.3 g (लगभग)
व्याख्या
दिया गयाविलयन की मोललता (m) = 0.15 mol kg⁻¹
विलायक = मेथेनॉल
मेथेनॉल का द्रव्यमान = 1 kg (मोललता की परिभाषा के अनुसार)
बेंज़ोइक अम्ल (C₆H₅COOH) का मोलर द्रव्यमान = 122 g mol⁻¹
Step 1: मोललता की परिभाषा लिखना
सूत्र : मोललता = विलेय के मोल / विलायक का द्रव्यमान (kg में)
Step 2: बेंज़ोइक अम्ल के मोल निकालना
मोललता = 0.15 m
विलायक = 1 kg
अतः विलेय (बेंज़ोइक अम्ल) के मोल = 0.15 mol
Step 3: बेंज़ोइक अम्ल का द्रव्यमान निकालना
सूत्र : द्रव्यमान = मोल × मोलर द्रव्यमान
द्रव्यमान = 0.15 mol x 122 g mol-1
= 18.3 g
क्या आप जानते हैं?
👉 मोललता में हमेशा 1 kg विलायक मानना standard तरीका है👉 मोललता ताप पर निर्भर नहीं करती
👉 ऐसे प्रश्नों में घनत्व की आवश्यकता नहीं होती
👉 पहले मोल निकालो, फिर द्रव्यमान
👉 परीक्षा ट्रिक: द्रव्यमान = m × मोलर द्रव्यमान (जब विलायक = 1 kg हो)
Q.31 एसीटिक अम्ल, ट्राइक्लोरोएसीटिक अम्ल तथा ट्राइफ्लुओरोएसीटिक अम्ल की समान मात्रा से जल के हिमांक में अवनमन उपरोक्त दिए गए क्रम में बढ़ता है। संक्षेप में समझाइए।
उत्तर
• जल के हिमांक में अवनमन का क्रम है:एसीटिक अम्ल < ट्राइक्लोरोएसीटिक अम्ल < ट्राइफ्लुओरोएसीटिक अम्ल
• कारण यह है कि इन अम्लों की आयनीकरण क्षमता (degree of ionization) क्रमशः बढ़ती जाती है, जिससे विलयन में कणों की संख्या बढ़ती है और हिमांक अवनमन अधिक होता है।
व्याख्या
मुख्य सिद्धांतहिमांक अवनमन एक अणुसंख्यक गुणधर्म है।
यह विलयन में उपस्थित कुल कणों की संख्या पर निर्भर करता है, न कि विलेय की प्रकृति पर।
Step 1: आयनीकरण का प्रभाव
• एसीटिक अम्ल (CH3COOH) एक दूर्बलअम्ल है।
• यह जल में कम आयनीकरण करता है।
• इसलिए विलयन में कणों की संख्या कम होती है।
→ हिमांक अवनमन कम होता है।
Step 2: इलेक्ट्रॉन आकर्षी समूहों का प्रभाव
• ट्राइक्लोरोएसीटिक अम्ल (CCl3COOH) में
तीन Cl परमाणु उपस्थित होते हैं।
• ट्राइफ्लुओरोएसीटिक अम्ल (CF3COOH) में
तीन F परमाणु उपस्थित होते हैं।
• Cl और F दोनों इलेक्ट्रॉन आकर्षी (–I प्रभाव) दिखाते हैं।
• F का –I प्रभाव Cl से अधिक होता है।
Step 3: आयनीकरण और कणों की संख्या
• –I प्रभाव बढ़ने से → O–H बंध कमजोर होता है
→ अम्लीय क्षमता बढ़ती है
→ आयनीकरण अधिक होता है
• इसलिए
– एसीटिक अम्ल → कम आयनीकरण
– ट्राइक्लोरोएसीटिक अम्ल → अधिक आयनीकरण
– ट्राइफ्लुओरोएसीटिक अम्ल → सर्वाधिक आयनीकरण
→ विलयन में कणों की संख्या इसी क्रम में बढ़ती है।
निष्कर्ष
आयनीकरण जितना अधिक → कणों की संख्या उतनी अधिक →
हिमांक अवनमन उतना अधिक
इसलिए क्रम है: CH3COOH < CCl3COOH < CF3COOH
क्या आप जानते हैं?
👉 हिमांक अवनमन कणों की संख्या पर निर्भर करता है👉 अधिक आयनीकरण → अधिक कण → अधिक ΔTf
👉 –I प्रभाव जितना अधिक → अम्लीय क्षमता उतनी अधिक
👉 F का –I प्रभाव Cl से अधिक होता है
👉 परीक्षा ट्रिक: Strong acid → more ions → more freezing point depression
Q.32 CH₃–CH₂–CHCl–COOH के 10 g को 250 g जल में मिलाने से होने वाले हिमांक के अवनमन की गणना कीजिए।
(दिया है: Kₐ = 1.4 × 10⁻³, Kf = 1.86 K kg mol⁻¹)
(दिया है: Kₐ = 1.4 × 10⁻³, Kf = 1.86 K kg mol⁻¹)
उत्तर
🤔 हिमांक अवनमन (ΔTf) = 0.65 K (लगभग)
व्याख्या
दिया गयाविलेय = CH₃CH₂CHClCOOH
विलेय का द्रव्यमान = 10 g
विलेय का मोलर द्रव्यमान (CH₃CH₂CHClCOOH) = 122.5 g mol⁻¹
विलायक (जल) का द्रव्यमान = 250 g = 0.250 kg
Kₐ = 1.4 × 10⁻³
Kf = 1.86 K kg mol⁻¹
Step 1: विलेय के मोल निकालना
मोल = द्रव्यमान / मोलर द्रव्यमान
मोल = 10/122.5 = 8.16 × 10−2 mol
Step 2: विलयन की मोललता निकालना
सूत्र : मोललता = विलेय के मोल / विलायक का द्रव्यमान (kg में)
m = 8.16 × 10−2/0.250 = 0.3264 mol kg−1
Step 3: आयनीकरण की डिग्री (α) निकालना
दूर्बल अम्ल के लिए:
α = √(Kₐ / C)
यहाँ, C ≈ m = 0.3264
α = √(1.4 × 10−3 / 0.3264) = 0.065
Step 4: van’t Hoff factor (i) निकालना
CH₃CH₂CHClCOOH ⇌ CH₃CH₂CHClCOO⁻ + H⁺
दूर्बल इलेक्ट्रोलाइट के लिए
i = 1 + α
i = 1 + 0.065 = 1.065
Step 5: हिमांक अवनमन की गणना
सूत्र :
ΔTf = i . Kf . m
ΔTf = 1.065 × 1.86 × 0.3264
ΔTf = 0.649 K ≈ 0.65 K
क्या आप जानते हैं?
👉 दूर्बल इलेक्ट्रोलाइट के लिए i = 1 + α👉 α = √(Kₐ / C) का उपयोग dilute विलयन में किया जाता है
👉 हिमांक अवनमन सांख्यिक गुण है, कणों की संख्या पर निर्भर करता है
👉 पहले मोललता, फिर α, फिर i निकालो
👉 परीक्षा ट्रिक: ΔTf = i . Kf . m
Q.33 CH₂FCOOH के 19.5 g को 500 g H₂O में घोलने पर जल के हिमांक में 1.0 °C का अवनमन देखा गया।
फ्लुओरोएसीटिक अम्ल का वैन्ट हॉफ गुणक तथा वियोजन स्थिरांक परिकलित कीजिए।
फ्लुओरोएसीटिक अम्ल का वैन्ट हॉफ गुणक तथा वियोजन स्थिरांक परिकलित कीजिए।
उत्तर
📌 वैन्ट हॉफ गुणक (i) = 1.075 (लगभग)📌 वियोजन स्थिरांक (Kₐ) = 3.1 × 10⁻³ (लगभग)
व्याख्या
दिया गया👉 विलेय = CH₂FCOOH
👉 विलेय (CH₂FCOOH) का द्रव्यमान = 19.5 g
👉 विलेय (CH₂FCOOH) का मोलर द्रव्यमान = 78 g mol⁻¹
👉 विलायक (जल) का द्रव्यमान = 500 g = 0.500 kg
👉 हिमांक अवनमन, ΔTf = 1.0 °C
👉 जल के लिए Kf = 1.86 K kg mol⁻¹
Step 1: विलेय के मोल निकालना
सूत्र: मोल = द्रव्यमान / मोलर द्रव्यमान
\( \text{मोल} = \frac{19.5\ \mathrm{g}}{78\ \mathrm{g\ mol^{-1}}} = 0.25\ \mathrm{mol} \)
Step 2: विलयन की मोललता निकालना
सूत्र : मोललता = विलेय के मोल / विलायक का द्रव्यमान (kg में)
\( m = \frac{0.25\ \mathrm{mol}}{0.500\ \mathrm{kg}} \)
\( m = 0.50\ \mathrm{mol\ kg^{-1}} \)
Step 3: वैन्ट हॉफ गुणक (i) निकालना
सूत्र:
\( \Delta T_f = i \times K_f \times m \)
\( i = \frac{\Delta T_f}{K_f \times m} \)
\( i = \frac{1.0\ \mathrm{K}}{1.86\ \mathrm{K\ kg\ mol^{-1}} \times 0.50\ \mathrm{mol\ kg^{-1}}} \)
\( i = 1.075 \)
Step 4: आयनीकरण की मात्रा (α) निकालना
\( \mathrm{CH_2FCOOH \rightleftharpoons CH_2FCOO^- + H^+} \)
यह एक मोनोप्रोटिक दूर्बल अम्ल है, अतः
\( i = 1 + \alpha \)
\( \alpha = i - 1 \)
\( \alpha = 1.075 - 1 = 0.075 \)
Step 5: वियोजन स्थिरांक (Kₐ) की गणना
सूत्र:
\( K_a = \frac{C\alpha^2}{1-\alpha} \)
यहाँ, \( C \approx m = 0.50\ \mathrm{mol\ L^{-1}} \)
\( K_a = \frac{0.50 \times (0.075)^2}{1 - 0.075} \)
\( K_a = \frac{0.0028}{0.925} \)
\( K_a = 3.1 \times 10^{-3} \)
क्या आप जानते हैं?
👉 दूर्बल इलेक्ट्रोलाइट के लिए i = 1 + α👉 हिमांक अवनमन से van’t Hoff factor सीधे निकाला जा सकता है
👉 Kₐ निकालने के लिए पहले α निकालना ज़रूरी है
👉 dilute विलयन में C ≈ m मानना safe रहता है
👉 परीक्षा ट्रिक: ΔTf → i → α → Kₐ (यही सही क्रम है)
Q.34: 293 K पर जल का वाष्प दाब 17.535 mm Hg है। यदि 25 g ग्लूकोज को 450 g जल में घोला जाए, तो 293 K पर जल का वाष्प दाब परिकलित कीजिए।
उत्तर
🤔 293 K पर विलयन का वाष्प दाब = 17.44 mm Hg (लगभग)
व्याख्या
दिया गया👉 ताप = 293 K
👉 शुद्ध जल का वाष्प दाब, P0 = 17.535 mm Hg
👉 ग्लूकोज का द्रव्यमान = 25 g
👉 ग्लूकोज का मोलर द्रव्यमान = 180 g mol⁻¹
👉 जल का द्रव्यमान = 450 g
👉 जल का मोलर द्रव्यमान = 18 g mol⁻¹
Step 1: जल और ग्लूकोज के मोल निकालना
सूत्र : मोल = द्रव्यमान / मोलर द्रव्यमान
विलेय (ग्लूकोज) के मोल:
\( n_1 = \frac{25\ \mathrm{g}}{180\ \mathrm{g\ mol^{-1}}} = 0.138\ \mathrm{mol} \)
जल के मोल:
\( n_2 = \frac{450\ \mathrm{g}}{18\ \mathrm{g\ mol^{-1}}} = 25\ \mathrm{mol} \)
Step 2: राउल्ट के नियम का प्रयोग
सूत्र : वाष्प दाब में सापेक्ष कमी = विलेय का मोल अंश
\( \frac{p^\circ - p_s}{p^\circ} = \frac{n_1}{n_1 + n_2} \)
Step 3: मान रखना
\( \frac{17.535 - p_s}{17.535} = \frac{0.138}{0.138 + 25} \)
Step 4: वाष्प दाब निकालना
\( 17.535 - p_s = \frac{0.138}{25.138} \times 17.535 \)
\( 17.535 - p_s = 0.096 \)
\( p_s = 17.535 - 0.096 \)
\( p_s = 17.44\ \mathrm{mm\ Hg} \)
क्या आप जानते हैं?
👉 अवाष्पशील विलेय के लिए राउल्ट का नियम सीधे लागू होता है👉 पहले मोल निकालना सबसे जरूरी step है
👉 dilute विलयन में वाष्प दाब में कमी बहुत कम होती है
👉 ग्लूकोज जैसे विलेय वाष्प दाब में कमी ही करते हैं
Q.35: 298 K पर मीथेन की बेंज़ीन में मोललता के लिए हेनरी स्थिरांक 4.27 × 10⁵ mm Hg है। 298 K तथा 760 mm Hg दाब पर बेंज़ीन में मीथेन की विलेयता परिकलित कीजिए।
उत्तर
👉 बेंज़ीन में मीथेन का मोल अंश = 1.78 × 10⁻³ (लगभग)
व्याख्या
दिया गयाताप = 298 K
हेनरी स्थिरांक, KH = 4.27 × 10⁵ mm Hg
मीथेन का दाब, p = 760 mm Hg
Step 1: हेनरी के नियम का सूत्र लिखना
सूत्र : गैस का आंशिक दाब = हेनरी स्थिरांक × विलयन में गैस का मोल अंश
\( p = K_H \times x \)
Step 2: मोल अंश (x) के लिए सूत्र लिखना
\( x = \frac{p}{K_H} \)
Step 3: मान रखना (units के साथ)
\( x = \frac{760\ \mathrm{mm\ Hg}}{4.27 \times 10^5\ \mathrm{mm\ Hg}} \)
Step 4: गणना
\( x = 1.78 \times 10^{-3} \)
क्या आप जानते हैं?
👉 हेनरी का नियम केवल कम दाब और dilute विलयनों पर लागू होता है👉 गैस की विलेयता को अक्सर मोल अंश के रूप में व्यक्त किया जाता है
👉 दाब बढ़ाने पर गैसों की विलेयता सीधे बढ़ती है
👉 ऐसे प्रश्नों में ताप स्थिर मानना बहुत जरूरी है
👉 परीक्षा ट्रिक: x = p / KH (सीधा और fastest तरीका)
Q.36: 100 g द्रव A (मोलर द्रव्यमान = 140 g mol⁻¹) को 1000 g द्रव B (मोलर द्रव्यमान = 180 g mol⁻¹) में घोला गया।
शुद्ध द्रव B का वाष्प दाब 500 Torr है। यदि विलयन का कुल वाष्प दाब 475 Torr हो, तो
(i) शुद्ध द्रव A का वाष्प दाब
(ii) विलयन में द्रव A का वाष्प दाब
परिकलित कीजिए।
शुद्ध द्रव B का वाष्प दाब 500 Torr है। यदि विलयन का कुल वाष्प दाब 475 Torr हो, तो
(i) शुद्ध द्रव A का वाष्प दाब
(ii) विलयन में द्रव A का वाष्प दाब
परिकलित कीजिए।
उत्तर
(i) शुद्ध द्रव A का वाष्प दाब = 280 Torr (लगभग) (ii) विलयन में द्रव A का वाष्प दाब = 32 Torr (लगभग)
व्याख्या
दिया गयाद्रव A का द्रव्यमान = 100 g
द्रव A का मोलर द्रव्यमान (MA) = 140 g mol⁻¹
द्रव B का द्रव्यमान = 1000 g
द्रव B का मोलर द्रव्यमान (MB) = 180 g mol⁻¹
शुद्ध द्रव B का वाष्प दाब, PB0 = 500 Torr
विलयन का कुल वाष्प दाब, PT = 475 Torr
Step 1: द्रव A और B के मोल निकालना
द्रव A के मोल
\( n_A = \frac{100\ \mathrm{g}}{140\ \mathrm{g\ mol^{-1}}} = 0.714\ \mathrm{mol} \)
द्रव B के मोल
\( n_B = \frac{1000\ \mathrm{g}}{180\ \mathrm{g\ mol^{-1}}} = 5.556\ \mathrm{mol} \)
कुल मोल = 0.714 + 5.556 = 6.270 mol
Step 2: द्रव B का मोल अंश निकालना
B का मोल अंश = B का मोल / कुल मोल
\( x_B = \frac{5.556}{6.270} = 0.886 \)
Step 3: विलयन में द्रव B का वाष्प दाब निकालना
राउल्ट का नियम:
\( p_B = x_B \times p_B^\circ \)
\( p_B = 0.886 \times 500 = 443\ \mathrm{Torr} \)
Step 4: विलयन में द्रव A का वाष्प दाब निकालना
कुल वाष्प दाब, \( P_T = p_A + p_B \)
\( p_A = P_T - p_B \)
\( p_A = 475 - 443 = 32\ \mathrm{Torr} \)
Step 5: द्रव A का मोल अंश निकालना
A का मोल अंश = A का मोल / कुल मोल
\( x_A = \frac{0.714}{6.270} = 0.114 \)
Step 6: शुद्ध द्रव A का वाष्प दाब निकालना
राउल्ट का नियम:
\( p_A = x_A \times p_A^\circ \)
\( p_A^\circ = \frac{p_A}{x_A} \)
\( p_A^\circ = \frac{32}{0.114} \)
\( p_A^\circ \approx 280\ \mathrm{Torr} \)
क्या आप जानते हैं?
👉 आदर्श विलयन में राउल्ट का नियम दोनों घटकों पर लागू होता है👉 कुल वाष्प दाब = दोनों आंशिक वाष्प दाबों का योग
👉 पहले जिस घटक का शुद्ध वाष्प दाब दिया हो, उसी से शुरुआत करो
👉 अंत में दूसरे घटक का वाष्प दाब आसानी से निकल जाता है
👉 परीक्षा ट्रिक: पहले pB, फिर pA, फिर pA0
Q.37: 328 K पर शुद्ध एसीटोन तथा क्लोरोफॉर्म के वाष्प दाब क्रमशः 741.8 mm Hg तथा 632.8 mm Hg हैं। यह मानते हुए कि संपूर्ण संघटन पर ये आदर्श विलयन बनाते हैं, एसीटोन के मोल अंश के फलन के रूप में
(i) एसीटोन का वाष्प दाब
(ii) क्लोरोफॉर्म का वाष्प दाब
(iii) कुल वाष्प दाब
आलेखित कीजिए। मिश्रण के विभिन्न संघटनों के प्रेक्षित प्रायोगिक आँकड़ों को भी उसी ग्राफ में दर्शाइए तथा बताइए कि इसमें आदर्श विलयन से धनात्मक अथवा ऋणात्मक विचलन है।
(i) एसीटोन का वाष्प दाब
(ii) क्लोरोफॉर्म का वाष्प दाब
(iii) कुल वाष्प दाब
आलेखित कीजिए। मिश्रण के विभिन्न संघटनों के प्रेक्षित प्रायोगिक आँकड़ों को भी उसी ग्राफ में दर्शाइए तथा बताइए कि इसमें आदर्श विलयन से धनात्मक अथवा ऋणात्मक विचलन है।
उत्तर
• एसीटोन–क्लोरोफॉर्म विलयन आदर्श विलयन से ऋणात्मक विचलन प्रदर्शित करता है।
व्याख्या
दिया गयाताप = 328 K
शुद्ध एसीटोन का वाष्प दाब = 741.8 mm Hg
शुद्ध क्लोरोफॉर्म का वाष्प दाब = 632.8 mm Hg
तालिका में विभिन्न संघटनों पर प्रेक्षित वाष्प दाब दिए गए हैं।
Step 1: आदर्श विलयन के लिए राउल्ट का नियम
एसीटोन के लिए
एसीटोन का वाष्प दाब = एसीटोन का मोल अंश × शुद्ध एसीटोन का वाष्प दाब
\( p_{\text{acetone}} = x_{\text{acetone}} \times p_{\text{acetone}}^\circ \)
क्लोरोफॉर्म के लिए
क्लोरोफॉर्म का वाष्प दाब = क्लोरोफॉर्म का मोल अंश × शुद्ध क्लोरोफॉर्म का वाष्प दाब
\( p_{\text{chloroform}} = x_{\text{chloroform}} \times p_{\text{chloroform}}^\circ \)
कुल वाष्प दाब
\( P_T = p_{\text{acetone}} + p_{\text{chloroform}} \)
Step 2: ग्राफ बनाने की विधि
• X-अक्ष: एसीटोन का मोल अंश
• Y-अक्ष: वाष्प दाब (mm Hg)
एक ही ग्राफ पर तीन वक्र बनाइए—
1. एसीटोन का वाष्प दाब बनाम एसीटोन का मोल अंश
2. क्लोरोफॉर्म का वाष्प दाब बनाम एसीटोन का मोल अंश
3. कुल वाष्प दाब बनाम एसीटोन का मोल अंश
अब तालिका में दिए गए प्रेक्षित (experimental) मानों को उसी ग्राफ पर बिंदुओं के रूप में प्लॉट कीजिए।
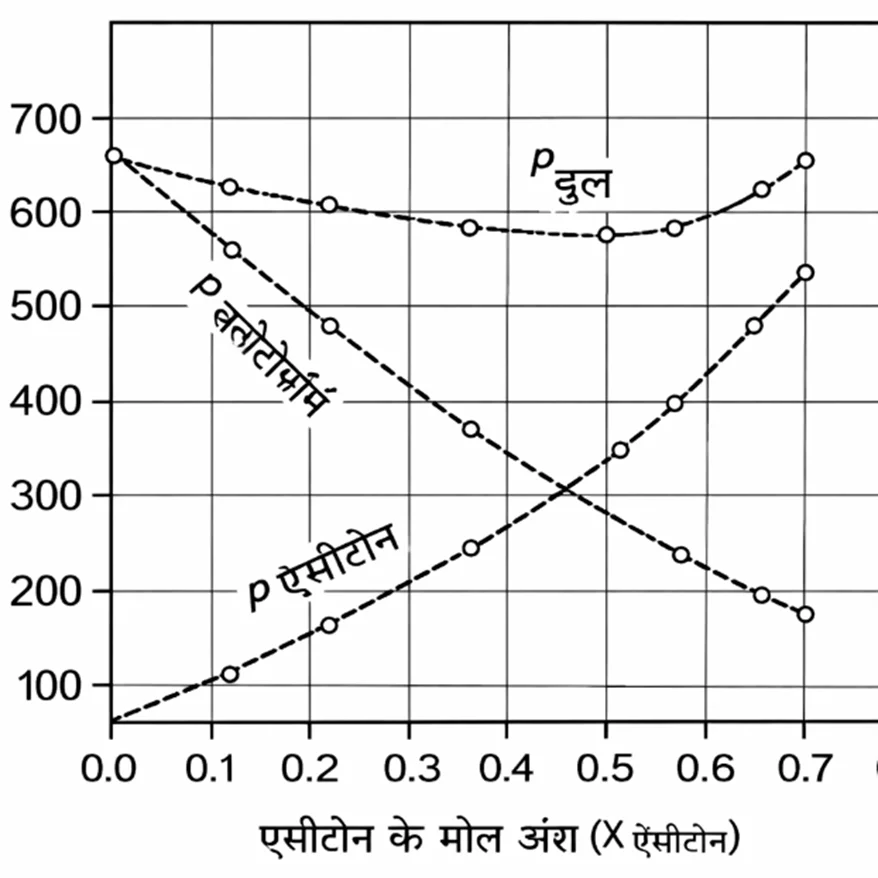
Step 3: प्रेक्षित आँकड़ों से निष्कर्ष
• प्रेक्षित कुल वाष्प दाब, राउल्ट के नियम से प्राप्त सैद्धांतिक कुल वाष्प दाब से कम है।
• अर्थात वास्तविक वक्र, आदर्श वक्र के नीचे स्थित होता है।
Step 4: विचलन का कारण
• एसीटोन और क्लोरोफॉर्म के बीच मज़बूत अंतराआणविक आकर्षण (हाइड्रोजन बॉन्डिंग) पाया जाता है।
• A–B आकर्षण, A–A तथा B–B आकर्षण से अधिक मज़बूत होता है।
• इसलिए अणु वाष्प अवस्था में जाने से रुकते हैं और वाष्प दाब घट जाता है।
निष्कर्ष
चूँकि वास्तविक वाष्प दाब आदर्श वाष्प दाब से कम है, अतः यह विलयन ऋणात्मक विचलन दर्शाता है।
क्या आप जानते हैं?
👉 मज़बूत A–B आकर्षण → ऋणात्मक विचलन👉 ऋणात्मक विचलन में, ΔH ऋणात्मक तथा ΔV ऋणात्मक होता है
👉 एसीटोन–क्लोरोफॉर्म पाठ्यपुस्तक का मानक उदाहरण है
👉 ग्राफ में आदर्श रेखा सीधी होती है, वास्तविक वक्र नीचे की ओर झुका होता है
👉 परीक्षा ट्रिक: राउल्ट के नियम से कम वाष्प दाब ⇒ ऋणात्मक विचलन
Q.38 संपूर्ण परास में बेंज़ीन तथा टॉल्यूइन आदर्श विलयन बनाते हैं। 300 K पर शुद्ध बेंज़ीन तथा टॉल्यूइन का वाष्प दाब क्रमशः 50.71 mm Hg तथा 32.06 mm Hg है। यदि 80 g बेंज़ीन को 100 g टॉल्यूइन में मिलाया जाए, तो वाष्प अवस्था में उपस्थित बेंज़ीन का मोल अंश परिकलित कीजिए।
उत्तर
•वाष्प अवस्था में बेंज़ीन का मोल अंश = 0.60
व्याख्या
दिया गयाबेंज़ीन का द्रव्यमान = 80 g
बेंज़ीन का मोलर द्रव्यमान = 78 g mol⁻¹
टॉल्यूइन का द्रव्यमान = 100 g
टॉल्यूइन का मोलर द्रव्यमान = 92 g mol⁻¹
शुद्ध बेंज़ीन का वाष्प दाब, p°(benzene) = 50.71 mm Hg
शुद्ध टॉल्यूइन का वाष्प दाब, p°(toluene) = 32.06 mm Hg
Step 1: बेंज़ीन और टॉल्यूइन के मोल निकालना
बेंज़ीन के मोल
\( n_{\mathrm{benzene}} = \frac{80\ \mathrm{g}}{78\ \mathrm{g\ mol^{-1}}} = 1.026\ \mathrm{mol} \)
टॉल्यूइन के मोल
\( n_{\mathrm{toluene}} = \frac{100\ \mathrm{g}}{92\ \mathrm{g\ mol^{-1}}} = 1.087\ \mathrm{mol} \)
कुल मोल = 1.026 + 1.087 = 2.113 mol
Step 2: द्रव अवस्था में मोल अंश निकालना
बेंज़ीन का मोल अंश (द्रव अवस्था में)
\( x_{\mathrm{benz}} = \frac{1.026}{2.113} = 0.486 \)
टॉल्यूइन का मोल अंश
\( x_{\mathrm{toluene}} = 1 - 0.486 = 0.514 \)
Step 3: राउल्ट के नियम से आंशिक वाष्प दाब निकालना
बेंज़ीन का आंशिक वाष्प दाब
\( p_{\mathrm{benz}} = x_{\mathrm{benz}} \times p_{\mathrm{benz}}^\circ \)
\( p_{\mathrm{benz}} = 0.486 \times 50.71 = 24.64\ \mathrm{mm\ Hg} \)
टॉल्यूइन का आंशिक वाष्प दाब
\( p_{\mathrm{tol}} = 0.514 \times 32.06 = 16.48\ \mathrm{mm\ Hg} \)
Step 4: कुल वाष्प दाब निकालना
\( P_T = P(\text{Benzene}) + P(\text{Toluene}) \)
\( P_T = 24.64 + 16.48 = 41.12\ \mathrm{mm\ Hg} \)
Step 5: वाष्प अवस्था में बेंज़ीन का मोल अंश
सूत्र: वाष्प अवस्था में मोल अंश = घटक का आंशिक वाष्प दाब / कुल वाष्प दाब
\( y_{\mathrm{benz}} = \frac{24.64}{41.12} = 0.60 \)
क्या आप जानते हैं?
👉 वाष्प अवस्था का मोल अंश हमेशा अधिक वाष्पशील घटक का ज्यादा होता है👉 बेंज़ीन का वाष्प दाब टॉल्यूइन से अधिक है, इसलिए वाष्प में बेंज़ीन ज्यादा होगा
👉 आदर्श विलयन में राउल्ट का नियम सीधे लागू होता है
👉 पहले द्रव अवस्था का मोल अंश निकालो, फिर वाष्प अवस्था का
👉 परीक्षा ट्रिक: Higher vapour pressure → Higher vapour phase mole fraction
Q.39: वायु अनेक गैसों का मिश्रण है। 298 K पर आयतन के अनुसार मुख्य घटक ऑक्सीजन तथा नाइट्रोजन लगभग 20% एवं 79% के अनुपात में हैं। 10 atm दाब पर जल वायु के साथ साम्य में है। 298 K पर यदि ऑक्सीजन तथा नाइट्रोजन के हेनरी स्थिरांक क्रमशः 3.30 × 10⁷ mm तथा 6.51 × 10⁷ mm हों, तो जल में इन गैसों का मोल अंश (संघटन) ज्ञात कीजिए।
उत्तर
👉 जल में ऑक्सीजन का मोल अंश (XO₂) = 4.61 × 10⁻⁵👉 जल में नाइट्रोजन का मोल अंश (XN₂) = 9.22 × 10⁻⁵
व्याख्या
दिया गयाकुल दाब = 10 atm
वायु में ऑक्सीजन = 20%
वायु में नाइट्रोजन = 79%
हेनरी स्थिरांक (298 K पर):
KH(O₂) = 3.30 × 10⁷ mm
KH(N₂) = 6.51 × 10⁷ mm
1 atm = 760 mm Hg
Step 1: ऑक्सीजन और नाइट्रोजन का आंशिक दाब निकालना
सूत्र : आंशिक दाब = आयतन प्रतिशत × कुल दाब
ऑक्सीजन का आंशिक दाब
\( \frac{20}{100} \times 10 = 2\ \mathrm{atm} \)
\( P_{O_2} = 2 \times 760 = 1520\ \mathrm{mm\ Hg} \)
नाइट्रोजन का आंशिक दाब
\( \frac{79}{100} \times 10 = 7.9\ \mathrm{atm} \)
\( P_{N_2} = 7.9 \times 760 = 6004\ \mathrm{mm\ Hg} \)
Step 2: हेनरी के नियम का प्रयोग
सूत्र : \( p = K_H \times x \)
अर्थात
\( x = \frac{p}{K_H} \)
Step 3: जल में ऑक्सीजन का मोल अंश
\( x_{O_2} = \frac{P_{O_2}}{K_H} \)
\( x_{O_2} = \frac{1520}{3.30 \times 10^7} \)
\( x_{O_2} = 4.61 \times 10^{-5} \)
Step 4: जल में नाइट्रोजन का मोल अंश
\( x_{N_2} = \frac{P_{N_2}}{K_H} \)
\( x_{N_2} = \frac{6004}{6.51 \times 10^7} \)
\( x_{N_2} = 9.22 \times 10^{-5} \)
क्या आप जानते हैं?
👉 हेनरी का नियम: p = Kₕ × x👉 पहले आंशिक दाब निकालो, फिर मोल अंश
👉 गैस का % दिया हो तो आंशिक दाब सीधे निकाला जा सकता है
👉 अधिक Kₕ → कम विलेयता
👉 परीक्षा ट्रिक: x = p / Kₕ (units पहले same कर लो)
Q.40: यदि जल का परासरण दाब 27°C पर 0.75 atm हो, तो 2.5 L जल में घुले CaCl₂ (i = 2.47) की मात्रा परिकलित कीजिए।
उत्तर
📌 घुले CaCl₂ की मात्रा = 3.42 g (लगभग)
व्याख्या
दिया गयापरासरण दाब, \( \pi \) = 0.75 atm
ताप, T = 27°C = 300 K
विलयन का आयतन, V = 2.5 L
van’t Hoff गुणक, i = 2.47
गैस नियतांक, R = 0.0821 L atm K⁻¹ mol⁻¹
CaCl₂ का मोलर द्रव्यमान = 40 + 2 × 35.5 = 111 g mol⁻¹
Step 1: परासरण दाब का सूत्र
सूत्र:
\( \pi = i \frac{n}{V} RT \)
मोल (n) के लिए—
\( n = \frac{\pi \times V}{i \times R \times T} \)
Step 2: मान रखना (units के साथ)
\( n = \frac{0.75\,\mathrm{atm} \times 2.5\,\mathrm{L}} {2.47 \times 0.0821\,\mathrm{L\,atm\,K^{-1}\,mol^{-1}} \times 300\,\mathrm{K}} \)
Step 3: CaCl₂ का मोल की गणना
\( n = \frac{1.875}{60.836} \)
\( n = 0.0308\ \mathrm{mol} \)
Step 4: CaCl₂ का द्रव्यमान निकालना
सूत्र : द्रव्यमान = CaCl₂ का मोल × CaCl₂ का मोलर द्रव्यमान
द्रव्यमान \( = 0.0308 \times 111 \)
\( = 3.42\ \mathrm{g} \)
क्या आप जानते हैं?
👉 परासरण दाब में van’t Hoff factor (i) बहुत महत्वपूर्ण होता है👉 CaCl₂ जैसे इलेक्ट्रोलाइट के लिए i > 1 होता है
👉 पहले n निकालो, फिर द्रव्यमान
👉 ताप को हमेशा Kelvin में बदलो
👉 परीक्षा ट्रिक: πV / (iRT) → moles → mass
Q.41: 25°C पर 2 लीटर जल में K₂SO₄ के 25 mg को घोलने पर बनने वाले विलयन का परासरण दाब ज्ञात कीजिए। यह मानते हुए कि K₂SO₄ पूर्णतः विघटित हो गया है।
उत्तर
📌 विलयन का परासरण दाब = 5.2 × 10⁻³ atm (लगभग)
व्याख्या
दिया गयाK₂SO₄ का द्रव्यमान = 25 mg = 0.025 g
विलयन का आयतन = 2 L
ताप = 25°C = 298 K
K₂SO₄ का मोलर द्रव्यमान = (2 × 39) + 32 + (4 × 16) = 174 g mol⁻¹
गैस नियतांक, R = 0.0821 L atm K⁻¹ mol⁻¹
Step 1: K₂SO₄ के मोल निकालना
सूत्र : मोल = द्रव्यमान / मोलर द्रव्यमान
\( n = \frac{0.025\ \mathrm{g}}{174\ \mathrm{g\ mol^{-1}}} \)
\( n = 0.0001436\ \mathrm{mol} \)
Step 2: van’t Hoff factor (i) निकालना
K₂SO₄ पूर्णतः विघटित होता है:
\( \mathrm{K_2SO_4 \rightarrow 2K^+ + SO_4^{2-}} \)
कुल आयन = 3
अतः \( i = 3 \)
Step 3: परासरण दाब का सूत्र लगाना
सूत्र:
\( \pi = i \frac{n}{V} RT \)
Step 4: मान रखना (units के साथ)
\( \pi = 3 \times \frac{0.0001436\,\mathrm{mol}}{2\,\mathrm{L}} \times 0.0821\,\mathrm{L\,atm\,K^{-1}\,mol^{-1}} \times 298\,\mathrm{K} \)
Step 5: गणना
\( \pi = 5.2 \times 10^{-3}\ \mathrm{atm} \)
क्या आप जानते हैं?
👉 परासरण दाब में i (van’t Hoff factor) बहुत महत्वपूर्ण होता है👉 पूर्ण विघटन वाले इलेक्ट्रोलाइट के लिए i = बनने वाले आयनों की संख्या
👉 mg को g में बदलना मत भूलना
👉 ताप हमेशा Kelvin में लेना ज़रूरी है
👉 परीक्षा ट्रिक: π = i nRT / V
ऐसे ही और numericals, theory questions और short tricks के लिए
आप हमारे Chemistry study section को explore कर सकते हैं।
सभी solutions NCERT pattern पर आधारित हैं।
अक्सर पूछे जाने वाले प्रश्न (FAQs)
कक्षा 12 रसायन विज्ञान अध्याय 1 विलयन क्यों महत्वपूर्ण है?
विलयन अध्याय में परासरण दाब, मोलरता और सांद्रता जैसे concepts शामिल हैं,
जिनसे बोर्ड परीक्षा और competitive exams में numericals पूछे जाते हैं।
क्या ये NCERT Solutions step-by-step समझाए गए हैं?
हाँ, सभी numericals को आसान भाषा में step-by-step हल किया गया है।
क्या ये content बोर्ड परीक्षा के लिए पर्याप्त है?
यह content NCERT syllabus पर आधारित और exam-oriented है।
क्या ये solutions competitive exams के लिए भी उपयोगी हैं?
जी हाँ, concepts की clarity competitive exams की base strong बनाती है।
