NCERT Solutions for Class 11 Chemistry Chapter 4 – Chemical Bonding and Molecular Structure (रासायनिक आबन्धन एवं आण्विक संरचना)
📘 यहाँ आपको Class 11 Chemistry Chapter 4 Chemical Bonding and Molecular Structure NCERT Solutions (Hindi + English Medium) में सभी महत्वपूर्ण प्रश्नों के सटीक उत्तर और Step-by-Step Explanation मिलेंगे। इस chapter में Kossel-Lewis concept, Ionic & Covalent bonding, Bond parameters, VSEPR theory, Valence Bond Theory (VBT), Hybridisation, Molecular Orbital Theory (MOT) और Hydrogen bonding को आसान भाषा में समझाया गया है ताकि आपकी board exam के साथ JEE/NEET preparation भी मजबूत हो। ✅
👉 किसी भी question को जल्दी ढूंढने के लिए नीचे दिए गए Search Box में Q. नंबर (जैसे Q.2, Q.15) या question का keyword (जैसे octet rule, VSEPR, hybridisation, MOT, bond angle, hydrogen bonding) टाइप करें। ✅
- Example: Search में लिखें: Q.8 या Hybridisation या Bond order
- Tip: 2–3 keyword से सही question जल्दी मिल जाता है।
- Mobile: Browser का Find in page (Chrome: Menu → Find in page) भी use कर सकते हैं।
✅ अणु में परमाणुओं को जोड़कर रखने वाला आकर्षण बल रासायनिक आबन्ध कहलाता है।
✅ कॉसेल-लूइस सिद्धांत के अनुसार बन्ध बनने के दो मुख्य तरीके हैं:
1. संयोजी इलेक्ट्रॉनों का स्थानान्तरण
2. संयोजी इलेक्ट्रॉनों का सहभाजन
✅ इन प्रक्रियाओं से परमाणु स्थिर इलेक्ट्रॉनिक विन्यास (अष्टक) की ओर बढ़ते हैं।
👉 पदार्थ में परमाणु प्रायः अकेले नहीं रहते, बल्कि समूह बनाकर स्थिर अवस्था में रहते हैं।
👉 इस स्थिर समूह को अणु कहते हैं।
👉 अणु में परमाणुओं को जोड़े रखने वाला बल ही रासायनिक आबन्ध है।
(ii) रासायनिक आबन्ध की परिभाषा
विभिन्न रासायनिक स्पीशीज में परमाणुओं/आयनों को साथ रखने वाला आकर्षण बल रासायनिक आबन्ध कहलाता है।
(iii) कॉसेल-लूइस अवधारणा
👉 परमाणु बन्ध बनाकर स्थिरता (विशेषकर अष्टक) प्राप्त करते हैं।
👉 यह या तो इलेक्ट्रॉन देने-लेने (स्थानान्तरण) से होता है,
👉 या इलेक्ट्रॉन युग्म साझा करने (सहभाजन) से।
(iv) NaCl से समझें
👉 Na एक इलेक्ट्रॉन छोड़ता है।
👉 Cl वही इलेक्ट्रॉन ग्रहण करता है।
👉 Na+ और Cl− बनते हैं और दोनों अधिक स्थिर हो जाते हैं।
👉 इनके बीच आकर्षण से आयनिक (विद्युत-संयोजी) आबन्ध बनता है।
✅ रासायनिक आबन्ध बनने का मुख्य कारण है: कम ऊर्जा + अधिक स्थिरता।
✅ इलेक्ट्रॉन स्थानान्तरण से आयनिक बन्ध, और इलेक्ट्रॉन सहभाजन से सहसंयोजी बन्ध बनता है।
• Mg (2,8,2) → 2 बिंदु
• Na (2,8,1) → 1 बिंदु
• B (2,3) → 3 बिंदु
• O (2,6) → 6 बिंदु
• N (2,5) → 5 बिंदु
• Br (2,8,18,7) → 7 बिंदु
लुईस बिंदु प्रतीक (Lewis Dot Symbols):
• Mg : •Mg•
• Na : Na•
• B : •B••
• O : :O:•• (कुल 6 बिंदु)
• N : :N••• (कुल 5 बिंदु)
• Br : :Br:••• (कुल 7 बिंदु)
नोट: बिंदुओं का वास्तविक स्थान (ऊपर/नीचे/दाएँ/बाएँ) अलग तरीके से बनाया जा सकता है, पर कुल संख्या संयोजी इलेक्ट्रॉनों के बराबर होनी चाहिए।
👉 किसी तत्व के रासायनिक प्रतीक के चारों ओर उसके बाह्यतम कोश के इलेक्ट्रॉनों को बिंदु (•) से दर्शाना ही लुईस बिंदु प्रतीक कहलाता है।
(ii) कैसे निकालें?
1. इलेक्ट्रॉनिक विन्यास लिखिए।
2. अंतिम कोश (outermost shell) में जितने इलेक्ट्रॉन हों, वही संयोजी इलेक्ट्रॉन हैं।
3. उतने ही बिंदु तत्व के प्रतीक के चारों ओर लगाइए।
(iii) दिए गए तत्वों पर लागू करें
• Mg (12): 2,8,2 → संयोजी इलेक्ट्रॉन = 2
• Na (11): 2,8,1 → संयोजी इलेक्ट्रॉन = 1
• B (5): 2,3 → संयोजी इलेक्ट्रॉन = 3
• O (8): 2,6 → संयोजी इलेक्ट्रॉन = 6
• N (7): 2,5 → संयोजी इलेक्ट्रॉन = 5
• Br (35): 2,8,18,7 → संयोजी इलेक्ट्रॉन = 7
✅ लुईस बिंदु प्रतीक रासायनिक आबन्ध (ionic/covalent bond) समझने का सबसे आसान प्रारम्भिक तरीका है।
✅ ऑक्सीजन (6) और ब्रोमीन (7) जैसे तत्व अष्टक पूरा करने के लिए इलेक्ट्रॉन ग्रहण या सहभाजन की प्रवृत्ति दिखाते हैं।
✅ यह नियम लूइस और कॉसेल (1916) द्वारा उत्कृष्ट गैसों की स्थिरता के आधार पर प्रस्तुत किया गया।
✅ आबन्ध निर्माण दो तरीकों से समझाया जाता है:
1. इलेक्ट्रॉन का स्थानान्तरण (आयनिक आबन्ध)
2. इलेक्ट्रॉनों का सहभाजन (सहसंयोजक आबन्ध)
👉 उत्कृष्ट गैसों के बाह्य कोश में पूर्ण विन्यास होता है, इसलिए वे अत्यन्त स्थिर रहती हैं।
👉 हीलियम में 2 इलेक्ट्रॉन (द्विक), जबकि अन्य प्रमुख उत्कृष्ट गैसों में बाह्य कोश में 8 इलेक्ट्रॉन (अष्टक) होते हैं।
👉 इसी स्थिरता को पाने के लिए अन्य तत्व रासायनिक संयोजन करते हैं।
(ii) अष्टक प्राप्ति कैसे होती है?
(a) इलेक्ट्रॉन स्थानान्तरण द्वारा
उदाहरण: सोडियम क्लोराइड
Na → Na+ + e−
Cl + e− → Cl−
Na+ + Cl− → NaCl
यहाँ Na और Cl दोनों उत्कृष्ट गैस जैसा विन्यास प्राप्त कर लेते हैं।
(b) इलेक्ट्रॉन सहभाजन द्वारा
दो परमाणु इलेक्ट्रॉन-युग्म साझा करके स्थिर विन्यास प्राप्त करते हैं (जैसे अनेक सहसंयोजक अणु)।
(iii) अष्टक नियम का महत्त्व
1. ✅ बहुत से अणुओं के निर्माण को सरलता से समझाता है (जैसे O2, N2, Cl2, Br2)।
2. ✅ आयनिक एवं सहसंयोजक आबन्ध की मूल अवधारणा स्पष्ट करता है।
3. ✅ कार्बनिक यौगिकों की संरचना समझने में बहुत उपयोगी है।
4. ✅ विशेष रूप से द्वितीय आवर्त के तत्वों के लिए अच्छा मार्गदर्शक नियम है।
(iv) अष्टक नियम की सीमाएँ (अपवाद)
अष्टक नियम सार्वत्रिक नहीं है। इसके प्रमुख अपवाद:
1) अपूर्ण अष्टक (Incomplete Octet)
कुछ यौगिकों में केन्द्रीय परमाणु के चारों ओर 8 से कम इलेक्ट्रॉन रहते हैं।
उदाहरण: BeH2, BCl3, AlCl3
2) विषम इलेक्ट्रॉन अणु (Odd Electron Molecules)
जिन अणुओं में कुल इलेक्ट्रॉन संख्या विषम होती है, वे सभी परमाणुओं पर अष्टक पूरा नहीं कर पाते।
उदाहरण: NO, NO2
3) प्रसारित अष्टक (Expanded Octet)
तीसरे या उससे आगे के आवर्त के तत्वों में केन्द्रीय परमाणु के चारों ओर 8 से अधिक इलेक्ट्रॉन हो सकते हैं।
उदाहरण: PF5, SF6, H2SO4
✅ हीलियम “द्विक” (2 इलेक्ट्रॉन) के कारण स्थिर है, इसलिए उसे अष्टक की आवश्यकता नहीं होती।
✅ परीक्षा में अष्टक नियम लिखते समय हमेशा 3 अपवाद जरूर लिखें:
अपूर्ण अष्टक, विषम इलेक्ट्रॉन अणु, प्रसारित अष्टक।
✅ कम आयनन एन्थैल्पी (cation बनना आसान हो)
✅ अधिक ऋणात्मक इलेक्ट्रॉन लब्धि एन्थैल्पी (anion बनना आसान हो)
✅ उच्च जालक ऊर्जा (क्रिस्टल बनते समय अधिक ऊर्जा विमुक्त हो)
इसी संयोजन से आयनिक यौगिक का निर्माण और स्थायित्व बढ़ता है।
👉 आयनिक आबन्ध में एक परमाणु इलेक्ट्रॉन त्यागकर धनायन बनाता है।
👉 इलेक्ट्रॉन निकालने के लिए जितनी कम ऊर्जा लगे, उतना बेहतर।
👉 इसलिए कम आयनन एन्थैल्पी आयनिक आबन्ध निर्माण के लिए अनुकूल है।
उदाहरण:
क्षार धातुएँ और क्षारीय मृदा धातुएँ सामान्यतः आसानी से धनायन बनाती हैं, क्योंकि उनकी आयनन एन्थैल्पी कम होती है।
(ii) इलेक्ट्रॉन लब्धि एन्थैल्पी का प्रभाव
👉 दूसरा परमाणु इलेक्ट्रॉन ग्रहण करके ऋणायन बनाता है।
👉 यदि इलेक्ट्रॉन ग्रहण करने पर अधिक ऊर्जा विमुक्त हो (अर्थात् मान अधिक ऋणात्मक हो), तो ऋणायन बनना आसान होता है।
👉 इसलिए अधिक ऋणात्मक इलेक्ट्रॉन लब्धि एन्थैल्पी अनुकूल है।
उदाहरण:
हैलोजन (वर्ग 17) इलेक्ट्रॉन आसानी से ग्रहण करते हैं, इसलिए वे आयनिक यौगिक बनाने में बहुत उपयुक्त होते हैं।
(iii) जालक ऊर्जा (Lattice Energy) का प्रभाव
👉 गैसीय आयन जब मिलकर ठोस क्रिस्टल बनाते हैं, तब ऊर्जा निकलती है।
👉 यह निकली हुई ऊर्जा जालक ऊर्जा कहलाती है।
👉 जालक ऊर्जा जितनी अधिक होगी, क्रिस्टल उतना स्थिर होगा और आयनिक आबन्ध उतना मजबूत होगा।
A+ (g)+B- (g)→A+ B- (s)+U
यहाँ U= जालक ऊर्जा
(iv) समग्र निष्कर्ष
👉 आयनिक यौगिक तब अधिक स्थिर बनता है जब:
आवश्यक आयनन एन्थैल्पी कम हो,
इलेक्ट्रॉन लब्धि एन्थैल्पी अधिक ऋणात्मक हो,
और जालक ऊर्जा का परिमाण बड़ा हो।
अर्थात् कुल मिलाकर ऊर्जा की दृष्टि से प्रक्रिया लाभकारी (अनुकूल) होनी चाहिए।
✅ छोटे आकार और अधिक आवेश वाले आयनों में आकर्षण अधिक होता है, इसलिए अक्सर जालक ऊर्जा भी अधिक होती है।
✅ परीक्षा में याद रखने का आसान क्रम:
IE कम + EGE अधिक ऋणात्मक + LE अधिक = आयनिक आबन्ध अनुकूल
✅ लेकिन H2O में ऑक्सीजन पर दो एकाकी युग्म होते हैं, जबकि NH3 में नाइट्रोजन पर एक एकाकी युग्म होता है।
✅ एकाकी युग्मों का प्रतिकर्षण अधिक होने से H2O में बन्ध-युग्म अधिक दबते हैं, इसलिए उसका बन्ध कोण कम हो जाता है।
✅ इसलिए:
• NH3 का बन्ध कोण ≈ 107°
• H2O का बन्ध कोण ≈ 104.5°
VSEPR के अनुसार केंद्रीय परमाणु के चारों ओर उपस्थित इलेक्ट्रॉन-युग्म एक-दूसरे को प्रतिकर्षित करते हैं और इस प्रकार व्यवस्थित होते हैं कि प्रतिकर्षण न्यूनतम हो।
प्रतिग्रहण का क्रम:
एकाकी-एकाकी > एकाकी-आबन्धी > आबन्धी-आबन्धी
अर्थात: lp-lp > lp-bp > bp-bp
(ii) NH3 में स्थिति
👉 केंद्रीय परमाणु N पर 4 इलेक्ट्रॉन-युग्म क्षेत्र होते हैं:
• 3 आबन्धी युग्म (N-H)
• 1 एकाकी युग्म
इसलिए आदर्श 109.5° से कोण थोड़ा घटकर लगभग 107° रह जाता है।
(iii) H2O में स्थिति
👉 केंद्रीय परमाणु O पर 4 इलेक्ट्रॉन-युग्म क्षेत्र होते हैं:
• 2 आबन्धी युग्म (O-H)
• 2 एकाकी युग्म
यहाँ एकाकी युग्म अधिक होने से कुल प्रतिकर्षण ज्यादा होता है, खासकर lp-lp और lp-bp प्रतिकर्षण के कारण O-H बन्ध-युग्म और पास आ जाते हैं।
इससे बन्ध कोण और कम होकर लगभग 104.5° हो जाता है।
(iv) निष्कर्ष
यद्यपि दोनों अणुओं का इलेक्ट्रॉनिक विन्यास चतुष्फलकीय है, पर H2O में एकाकी युग्मों की संख्या अधिक होने से प्रतिकर्षण अधिक होता है, इसलिए उसका बन्ध कोण NH3 से कम होता है।
✅ एकाकी युग्म अधिक जगह घेरते हैं, इसलिए बन्ध-युग्मों को ज्यादा दबाते हैं।
✅ यही कारण है कि सामान्य क्रम मिलता है:
CH4 (109.5°) > NH3 (107°) > H2O (104.5°)
✅ अर्थात् आबन्ध-कोटि जितनी अधिक, आबन्ध उतना अधिक प्रबल।
✅ क्योंकि आबन्ध-कोटि बढ़ने पर सामान्यतः आबन्ध विघटन एन्थैल्पी (Bond Dissociation Enthalpy) बढ़ती है।
आबन्ध प्रबलता ∝ आबन्ध-कोटि
👉 किसी आबन्ध को तोड़ने के लिए जितनी अधिक ऊर्जा चाहिए, वह आबन्ध उतना ही मजबूत माना जाता है।
👉 इस ऊर्जा को आबन्ध विघटन एन्थैल्पी कहते हैं।
(ii) आबन्ध-कोटि का प्रभाव
👉 आबन्ध-कोटि (Bond Order) बढ़ने का मतलब है कि दो परमाणुओं के बीच साझा इलेक्ट्रॉनों की संख्या बढ़ी है।
👉 इससे आकर्षण बढ़ता है, आबन्ध छोटा और मजबूत होता है।
👉 इसलिए आबन्ध एन्थैल्पी भी बढ़ती है।
(iii) उदाहरण से स्पष्ट करें
• N2 में आबन्ध-कोटि = 3, आबन्ध एन्थैल्पी ≈ 945 kJ mol−1
• O2 में आबन्ध-कोटि = 2, आबन्ध एन्थैल्पी ≈ 498 kJ mol−1
👉 चूँकि N2 की आबन्ध-कोटि अधिक है, इसलिए उसका आबन्ध O2 से अधिक प्रबल है।
(iv) निष्कर्ष
✅ आबन्ध प्रबलता को आबन्ध-कोटि के माध्यम से इस प्रकार व्यक्त किया जा सकता है कि दोनों में प्रत्यक्ष समानुपाती संबंध है:
Bond Order ↑ ⇒ Bond Strength ↑ ⇒ Bond Dissociation Enthalpy ↑
✅ आबन्ध-कोटि बढ़ने पर आबन्ध लंबाई प्रायः घटती है।
✅ इसलिए त्रि-आबन्ध वाले अणु (जैसे N2) बहुत स्थिर और मजबूत होते हैं।
✅ इसका मान सामान्यतः पिकोमीटर (pm) में व्यक्त किया जाता है।
1 pm = 10−12 m
👉 जब दो परमाणु आबन्ध बनाते हैं, तो उनके नाभिकों के बीच एक निश्चित संतुलित दूरी स्थापित होती है।
👉 यही संतुलित (equilibrium) दूरी उस आबन्ध की आबन्ध-लम्बाई कहलाती है।
(ii) इकाई
👉 आबन्ध-लम्बाई बहुत छोटी दूरी होती है, इसलिए इसे सामान्यतः pm (पिकोमीटर) में लिखा जाता है।
(iii) आयनिक यौगिकों में
👉 आयनिक यौगिकों में आबन्ध-लम्बाई लगभग:
धनायन की आयनिक त्रिज्या + ऋणायन की आयनिक त्रिज्या
(iv) सहसंयोजी यौगिकों में
👉 सहसंयोजी यौगिकों में आबन्ध-लम्बाई लगभग:
दोनों आबन्धित परमाणुओं की सहसंयोजी (परमाणु) त्रिज्याओं का योग
✅ छोटा आबन्ध अक्सर अधिक प्रबल आबन्ध का संकेत देता है।
✅ एक ही प्रकार के परमाणुओं में भी अलग-अलग आबन्ध (एकल/द्वि/त्रि) की लम्बाई अलग होती है।
N2 < SO2 < ClF3 < LiF < K2O
परमाणुओं की विद्युतऋणात्मकता का अन्तर (Δχ)
अणु/यौगिक की संरचना (geometry)
धातु-अधातु संयोग होने पर आयनिक लक्षण सामान्यतः अधिक होते हैं
(i) N2
👉 दोनों परमाणु समान हैं, Δχ = 0
👉 शुद्ध सहसंयोजक (सबसे कम आयनिक)
(ii) SO2
👉 S और O के बीच Δχ मध्यम है
👉 ध्रुवीय सहसंयोजक, पर आयनिक लक्षण N2 से अधिक
(iii) ClF3
👉 Cl-F में Δχ SO2 से अधिक
👉 T-आकृति के कारण बन्धों की ध्रुवीयता का प्रभाव स्पष्ट रहता है
👉 इसलिए SO2 से अधिक आयनिक लक्षण
(iv) LiF
👉 Li (धातु) + F (अधातु), Δχ बहुत अधिक
👉 बहुत अधिक आयनिक यौगिक
(v) K2O
👉 K (बहुत विद्युतधनात्मक धातु) और O (अधातु)
👉 कुल मिलाकर अत्यधिक आयनिक प्रकृति
👉 दिए गए विकल्पों में इसे सर्वाधिक आयनिक माना जाता है
निष्कर्ष
इसलिए आबन्धों की बढ़ती आयनिक प्रकृति का क्रम:
N2 < SO2 < ClF3 < LiF < K2O
✅ समान परमाणुओं के बीच बना आबन्ध (जैसे N2, O2) आयनिक नहीं होता।
✅ धातु + अधातु संयोजन में आयनिक लक्षण प्रायः बहुत अधिक होते हैं।
✅ कार्बन (द्वितीय आवर्त तत्व) के संयोजक कोश में d-कक्षक उपलब्ध नहीं होते, इसलिए वह dsp2 संकरण नहीं कर सकता।
✅ CH4 में कार्बन sp3 संकरण करता है, इसलिए इसकी वास्तविक आकृति चतुष्फलकीय (tetrahedral) होती है।
👉 वर्ग-समतली व्यवस्था में चार आबन्ध एक ही समतल में 90° पर व्यवस्थित होते हैं।
👉 ऐसी ज्यामिति सामान्यतः dsp2 संकरण से जुड़ी होती है।
(ii) कार्बन की सीमा
👉 कार्बन का परमाणु क्रमांक 6 है और यह द्वितीय आवर्त का तत्व है।
👉 द्वितीय आवर्त में केवल 2s और 2p कक्षक उपलब्ध होते हैं, 2d कक्षक नहीं होते।
👉 इसलिए कार्बन dsp2 संकरण नहीं कर सकता।
(iii) CH4 में वास्तविक संकरण
👉 CH4 में कार्बन एक 2s और तीन 2p कक्षकों का मिश्रण करके sp3 संकरण बनाता है।
👉 sp3 संकरण से 4 समतुल्य संकर कक्षक बनते हैं, जो अधिकतम दूरी बनाए रखने हेतु चतुष्फलकीय दिशा में व्यवस्थित होते हैं।
👉 इसलिए H-C-H बन्ध कोण लगभग 109.5° होता है, 90° नहीं।
(iv) निष्कर्ष
✅ d-कक्षक की अनुपस्थिति के कारण CH4 वर्ग-समतली नहीं हो सकता।
✅ CH4 की स्थिर और वास्तविक आकृति चतुष्फलकीय ही होती है।
✅ CH4 की चतुष्फलकीय आकृति को VSEPR सिद्धान्त भी समर्थन देता है, क्योंकि 4 बन्ध-युग्म न्यूनतम प्रतिकर्षण के लिए tetrahedral व्यवस्था लेते हैं।
✅ वर्ग-समतली संरचना अधिकतर d-कक्षक उपलब्ध होने वाले तत्वों के कुछ यौगिकों में पाई जाती है, कार्बन में नहीं।
AlCl3+Cl−→AlCl4−
✅ AlCl3 में Al = sp2
✅ AlCl4− में Al = sp3
✅ अतः संकरण परिवर्तन:
▭(sp2→sp3)
👉 Al के संयोजक इलेक्ट्रॉन अपेक्षाकृत कम होने के कारण AlCl3 में Al के चारों ओर तीन बन्ध बनते हैं।
👉 तीन इलेक्ट्रॉन-घनत्व क्षेत्रों के कारण ज्यामिति त्रिकोणीय समतली होती है।
👉 इसलिए Al का संकरण sp2 माना जाता है।
(ii) Cl− के जुड़ने पर क्या होता है?
👉 Cl− के पास एक एकाकी इलेक्ट्रॉन-युग्म होता है, जो Al के रिक्त कक्षक में दान कर देता है (समन्वय बन्ध बनता है)।
👉 अब Al के चारों ओर कुल 4 बन्ध/इलेक्ट्रॉन-घनत्व क्षेत्र हो जाते हैं।
(iii) AlCl4− में Al का संकरण
👉 चार क्षेत्रों के लिए उपयुक्त संकरण sp3 होता है।
👉 इसलिए AlCl4− की ज्यामिति चतुष्फलकीय होती है।
(iv) निष्कर्ष
इस अभिक्रिया में Al का संकरण sp2 से sp3 में परिवर्तित होता है।
✅ Cl− लुईस क्षार की तरह इलेक्ट्रॉन-युग्म दान करता है और समन्वय यौगिक AlCl4− बनता है।
✅ संकरण बदलने के साथ अणु/आयन की ज्यामिति भी बदल जाती है।
(क) 1s तथा 1s
(ख) 1s तथा 2px
(ग) 2py तथा 2py
(घ) 1s तथा 2s
✅ σआबन्ध बनाएँगे:
(क) 1s–1s
(ख) 1s–2px
(घ) 1s–2s
👉 σआबन्ध बनने के लिए अक्षीय (head-on) अतिव्यापन चाहिए।
👉 यानी दोनों कक्षक अन्तरनाभिकीय अक्ष (यहाँ x-अक्ष) के along overlap करें।
(ii) प्रत्येक विकल्प का परीक्षण
(क) 1s और 1s
👉 दोनों s-कक्षक गोलकीय सममित होते हैं।
👉 सीधे head-on overlap कर सकते हैं।
✅ इसलिए σआबन्ध बनेगा।
(ख) 1s और 2px
👉 2px कक्षक x-अक्ष के अनुदिश होता है।
👉 1s के साथ समाक्षीय अतिव्यापन संभव है।
✅ इसलिए σआबन्ध बनेगा।
(ग) 2py और 2py
👉 2py कक्षक y-दिशा में अनुदिश होता है , x-अक्ष के अनुदिश नहीं।
👉 इसलिए समाक्षीय अतिव्यापन नहीं होगा।
❌ अतः σआबन्ध नहीं बनेगा।
👉 ये कक्षक पार्श्ववत (sidewise) अतिव्यापन करके π आबन्ध बना सकते हैं।
(घ) 1s और 2s
👉 दोनों s-कक्षक हैं, गोलकीय सममित।
👉 समाक्षीय अतिव्यापन संभव है।
✅ इसलिए σआबन्ध बनेगा।
✅ अगर अन्तरनाभिकीय अक्ष x है, तो px समाक्षीय अतिव्यापन देकर σबना सकता है; py/pz सामान्यतः πबनाते हैं।
✅ s-कक्षक लगभग हर दिशा में overlap कर सकते हैं, इसलिए वे σआबन्ध बनाने में बहुत सामान्य हैं।
✅ सामान्यतः σ-आबन्ध अधिक प्रबल होता है, जबकि π-आबन्ध अपेक्षाकृत कम प्रबल होता है।
| क्र.सं. | आधार | σ-आबन्ध (Sigma Bond) | π-आबन्ध (Pi Bond) |
|---|---|---|---|
| 1 | बनने का तरीका | कक्षकों के अक्षीय (head-on) अतिव्यापन से बनता है। | कक्षकों के पार्श्व (sidewise) अतिव्यापन से बनता है। |
| 2 | कौन-से कक्षक भाग लेते हैं | s-s, s-p, p-p तथा संकरित कक्षकों के अतिव्यापन से बन सकता है। | सामान्यतः असंकरित p-p (कभी-कभी d) कक्षकों के पार्श्व अतिव्यापन से बनता है। |
| 3 | घूर्णन (Rotation) | आबन्ध-अक्ष के चारों ओर घूर्णन सम्भव होता है। | मुक्त घूर्णन सम्भव नहीं, क्योंकि घूर्णन से पार्श्व अतिव्यापन टूट जाता है। |
| 4 | प्रबलता और स्थायित्व | अधिक प्रबल और अधिक स्थायी होता है। | अपेक्षाकृत कम प्रबल और कम स्थायी होता है। |
| 5 | स्वतंत्र अस्तित्व | अकेले बन सकता है (एकल आबन्ध में यही होता है)। | अकेले नहीं बनता, हमेशा σ-आबन्ध के साथ अतिरिक्त रूप में बनता है। |
| 6 | अणु पर प्रभाव | अणु का मुख्य ढाँचा/आकृति निर्धारित करता है। | द्वि/त्रि आबन्ध की प्रकृति, क्रियाशीलता तथा कुछ मामलों में संरचना/बन्ध कोण को प्रभावित करता है। |
| 7 | उदाहरण | एकल आबन्ध = 1σ | द्वि-आबन्ध = 1σ + 1π; त्रि-आबन्ध = 1σ + 2π |
✅ σ-आबन्ध में इलेक्ट्रॉन घनत्व अन्तरनाभिकीय अक्ष पर अधिक होता है, इसलिए यह मजबूत होता है।
✅ कार्बनिक अभिक्रियाओं में π-इलेक्ट्रॉन अपेक्षाकृत अधिक क्रियाशील होते हैं।
✅ दोनों परमाणु पास आने पर आकर्षण और प्रतिकर्षण बल साथ-साथ कार्य करते हैं।
✅ एक निश्चित दूरी पर शुद्ध आकर्षण अधिकतम प्रभावी होकर ऊर्जा न्यूनतम कर देता है, तब स्थिर H2 अणु बनता है।
✅ H2 की आबन्ध-लम्बाई लगभग 74 pm और आबन्ध वियोजन ऊर्जा लगभग 433 kJ mol−1 होती है।
👉 संयोजकता आबन्ध सिद्धान्त (VBT) को हाइटलर और लंडन (1927) ने प्रस्तुत किया, बाद में पॉलिंग आदि ने विकसित किया।
👉 इस सिद्धान्त में आबन्ध निर्माण को कक्षक-अतिव्यापन और ऊर्जा परिवर्तन के आधार पर समझाया जाता है।
(ii) प्रारम्भिक अवस्था
दो H परमाणु लें:
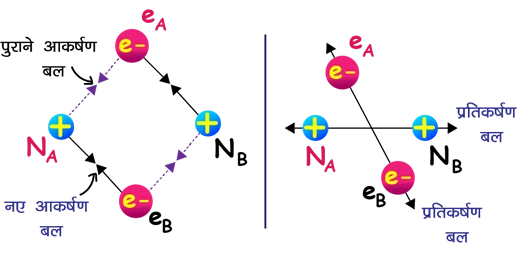
👉 परमाणु A (नाभिक NA, इलेक्ट्रॉन eA)
👉 परमाणु B (नाभिक NB, इलेक्ट्रॉन eB)
जब दोनों बहुत दूर होते हैं, तब कोई उल्लेखनीय अन्योन्यक्रिया नहीं होती।
(iii) पास आने पर बलों का निर्माण
आकर्षण बल:
NA-eA, NB-eB (आंतरिक आकर्षण)
NA-eB, NB-eA (परस्पर आकर्षण)
प्रतिकर्षण बल:
eA-eB (इलेक्ट्रॉन-इलेक्ट्रॉन)
NA-NB (नाभिक-नाभिक)
(iv) स्थिरता कब मिलती है?
👉 पास आने पर कुल ऊर्जा घटती है, क्योंकि प्रभावी आकर्षण प्रतिकर्षण से अधिक होता है।
👉 एक बिंदु पर आकर्षण और प्रतिकर्षण संतुलित हो जाते हैं।
👉 इसी संतुलित दूरी पर ऊर्जा न्यूनतम होती है और स्थिर H2 अणु बनता है।
👉 यह दूरी आबन्ध-लम्बाई = 74 pm है।
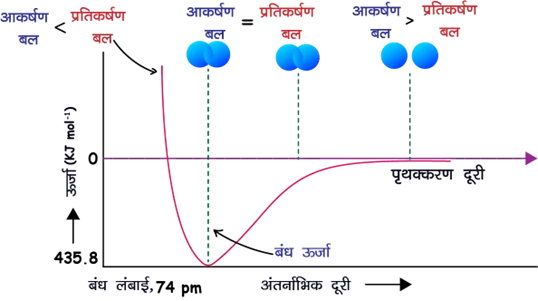
(v) ऊर्जा परिवर्तन
H(g)+H(g)→H2(g)+433 kJ mol−1
👉 आबन्ध बनने पर ऊर्जा मुक्त होती है, इसलिए H2 अधिक स्थायी है।
विलोम प्रक्रिया:
H2(g)→H(g)+H(g) (ΔH = +433 kJ mol−1)
👉 यही ऊर्जा आबन्ध वियोजन ऊर्जा कहलाती है।
(vi) निष्कर्ष
✅ H2 का विरचन 1s-1s के प्रभावी अतिव्यापन से बनते σ-आबन्ध के कारण होता है।
✅ न्यूनतम ऊर्जा अवस्था ही अधिकतम स्थायित्व की अवस्था है।
✅ H-H आबन्ध बनने पर ऊर्जा निकलना बताता है कि आबन्ध निर्माण सामान्यतः ऊर्जात्मक रूप से अनुकूल होता है।
✅ 1s-1s axial overlap से बनने वाला आबन्ध σ-आबन्ध कहलाता है।
✅ संयोग करने वाले परमाणु कक्षकों की ऊर्जा समान या लगभग समान हो।
✅ संयोग करने वाले कक्षकों की सममिति (आणविक अक्ष के सापेक्ष) समान हो।
✅ कक्षकों के बीच अधिकतम अतिव्यापन (overlap) होना चाहिए।
👉 जो परमाणु कक्षक आपस में मिलकर आण्विक कक्षक बनाएँगे, उनकी ऊर्जाएँ समान या बहुत निकट होनी चाहिए।
👉 ऊर्जा का अंतर बहुत अधिक होने पर प्रभावी संयोग नहीं होता।
उदाहरण:
👉 समान परमाणु में 1s-1s संयोग संभव है।
👉 1s और 2s के बीच ऊर्जा अंतर बहुत अधिक होने से संयोग प्रभावी नहीं होता।
👉 भिन्न परमाणुओं में यह नियम “लगभग समान” ऊर्जा के रूप में लागू होता है।
2) सममिति की समानता (Symmetry Condition)
👉 आण्विक अक्ष (सामान्यतः z-अक्ष) के सापेक्ष कक्षकों की सममिति समान होनी चाहिए।
👉 यदि सममिति मेल नहीं खाती, तो संयोग नहीं होगा, चाहे ऊर्जा पास-पास हो।
उदाहरण:
👉 2pz कक्षक दूसरे 2pz से संयोग कर सकता है।
👉 2pz का 2px या 2py से सममिति भिन्न होने पर प्रभावी संयोग नहीं होता।
3) अधिकतम अतिव्यापन (Maximum Overlap)
👉 संयोग के लिए कक्षकों का अतिव्यापन जितना अधिक होगा, उतना अच्छा बन्धन आण्विक कक्षक बनेगा।
👉 अधिक overlap से नाभिकों के बीच इलेक्ट्रॉन घनत्व बढ़ता है, जिससे बन्धन अधिक स्थिर होता है।
निष्कर्ष
LCAO के सफल होने के लिए तीनों बातें साथ में जरूरी हैं:
ऊर्जा मेल + सममिति मेल + पर्याप्त अतिव्यापन।
इन्हीं शर्तों के पूरा होने पर स्थिर बन्धन (bonding MO) प्रभावी रूप से बनता है।
✅ अधिक overlap का अर्थ प्रायः अधिक मजबूत बन्धन है।
✅ MO सिद्धान्त में bond order और चुम्बकीय गुण समझने की क्षमता LCAO की इन्हीं शर्तों पर आधारित है।
✅ ये चिह्न कक्षक तरंग-फलन (wave function) के चरण/फेज (phase) को दर्शाते हैं।
✅ समान फेज के अतिव्यापन से आबन्धी आण्विक कक्षक बनता है, जबकि विपरीत फेज के अतिव्यापन से प्रतिआबन्धी आण्विक कक्षक बनता है।
👉 परमाणु कक्षक की पालियों (lobes) पर +/– चिह्न केवल गणितीय संकेत हैं, जो तरंग-फलन के चिह्न (phase) को दिखाते हैं।
👉 इनका अर्थ धनात्मक/ऋणात्मक विद्युत आवेश नहीं है।
(ii) समान चिह्न (in-phase overlap)
👉 जब दो कक्षकों की अतिव्यापित पालियों का फेज समान हो
(+ के साथ + या – के साथ –),
तो संरचनात्मक अतिव्यापन होता है।
👉 नाभिकों के बीच इलेक्ट्रॉन घनत्व बढ़ता है।
✅ परिणाम: आबन्धी (bonding) MO बनता है।
(iii) असमान चिह्न (out-of-phase overlap)
👉 जब अतिव्यापित पालियों का फेज विपरीत हो
(+ के साथ –),
तो विनाशात्मक अतिव्यापन होता है।
👉 नाभिकों के बीच इलेक्ट्रॉन घनत्व घटता/नोड बनता है।
✅ परिणाम: प्रतिआबन्धी (antibonding) MO बनता है।
(iv) निष्कर्ष
कक्षकों के +/– चिह्न MO निर्माण में यह तय करते हैं कि अतिव्यापन से बन्धन मजबूत होगा या कमजोर।
👉 समान फेज → bonding
👉 विपरीत फेज → antibonding
✅ कक्षक का “phase” बदलने से overlap का परिणाम पूरी तरह बदल सकता है।
✅ रासायनिक आबन्ध की प्रकृति समझने में phase relation बहुत महत्वपूर्ण है।
✅ हाइड्रोजन आबन्ध की शक्ति की तुलना में यह कहा जाता है कि यह वाण्डरवाल्स बलों से सामान्यतः अधिक मजबूत माना जाता है, पर आपके दिए गए संदर्भ के अनुसार इसे वाण्डरवाल्स बलों की अपेक्षा दुर्बल बताया गया है।
✅ परीक्षा में उत्तर लिखते समय अपने पाठ्य-स्रोत/नोट्स के अनुसार ही लिखें।
👉 जब H किसी अत्यधिक विद्युतऋणात्मक परमाणु (F, O, N) से सहसंयोजक रूप से जुड़ा हो, तो H पर आंशिक धनावेश (δ+) आता है।
👉 यह δ+हाइड्रोजन, पड़ोसी अणु के F/O/N के एकाकी युग्म की ओर आकर्षित होता है।
👉 यही विशेष आकर्षण हाइड्रोजन आबन्ध कहलाता है।
(ii) उदाहरण
👉 H2O में O-H···O
👉 HF में H-F···F
👉 NH3 में N-H···N
(iii) वाण्डरवाल्स बलों से तुलना
👉 आपके दिए गए टेक्स्ट में इसे वाण्डरवाल्स बलों की अपेक्षा दुर्बल बताया गया है।
👉 इसलिए इसी संदर्भ-आधारित उत्तर में:
हाइड्रोजन आबन्ध = वाण्डरवाल्स बलों की अपेक्षा दुर्बल |
✅ बर्फ की खुली संरचना भी हाइड्रोजन आबन्धन से ही बनती है।
✅ जैव-अणुओं (जैसे DNA, प्रोटीन) की संरचना स्थिर रखने में भी हाइड्रोजन आबन्ध महत्त्वपूर्ण है।
📘 Chapter FAQs: Chemical Bonding and Molecular Structure (Class 11 Chemistry)
Quick revision for NCERT Chemistry chapter questions on ionic bond, covalent bond, VSEPR, hybridisation, MOT, bond angle, bond order, and hydrogen bonding.
