NCERT Solutions for Class 12 Chemistry Chapter 2 Electrochemistry in Hindi
Class 12 Chemistry का Chapter 2 – Electrochemistry छात्रों के लिए थोड़ा challenging माना जाता है, लेकिन सही explanation और step-by-step solutions के साथ यह chapter आसान बन सकता है। इस पोस्ट में आपको NCERT Solutions for Class 12 Chemistry Chapter 2 Electrochemistry in Hindi मिलेंगे, जो NCERT textbook और CBSE syllabus के अनुसार पूरी तरह तैयार किए गए हैं।
ये solutions खास तौर पर उन छात्रों के लिए हैं जो concepts को हिंदी में स्पष्ट रूप से समझना चाहते हैं और board exam की तैयारी मजबूत करना चाहते हैं।
Mg > Al > Zn > Fe > Cu
👉 धातुओं की विस्थापन क्षमता को समझने के लिए हम धातु क्रियाशीलता श्रेणी (Reactivity series) का उपयोग करते हैं।
दी गई धातुओं की अभिक्रियाशीलता इस क्रम में होती है:
• Mg (मैग्नीशियम) – सबसे अधिक अभिक्रियाशील
• Al (एल्युमिनियम)
• Zn (जिंक)
• Fe (लोहा)
• Cu (तांबा) – सबसे कम अभिक्रियाशील
👉 इसलिए जो धातु सूची में ऊपर है, वह नीचे वाली धातु को उसके लवण विलयन से विस्थापित कर सकती है।
👉 Cu लगभग सभी दी गई धातुओं द्वारा विस्थापित हो सकता है
👉 Mg सबसे प्रबल reducing agent है
👉 परीक्षा ट्रिक (याद रखने के लिए): Mg Al Zn Fe Cu (ऊपर से नीचे = शक्ति कम होती जाती है)
K⁺/K = –2.93 V, Ag⁺/Ag = +0.80 V, Hg²⁺/Hg = +0.79 V, Mg²⁺/Mg = –2.37 V, Cr³⁺/Cr = –0.74 V
Ag < Hg < Cr < Mg < K
• किसी धातु की अपचायक क्षमता उसके मानक अपचयन विभव (E°) पर निर्भर करती है।
• E° का मान जितना अधिक ऋणात्मक (negative) होगा, धातु की अपचायक क्षमता उतनी अधिक होगी।
कारण
• अधिक ऋणात्मक E° वाली धातु इलेक्ट्रॉन आसानी से छोड़ती है।
• इसलिए वह एक अच्छा reducing agent होती है।
दिए गए E° मान
• Ag⁺/Ag = +0.80 V
• Hg²⁺/Hg = +0.79 V
• Cr³⁺/Cr = –0.74 V
• Mg²⁺/Mg = –2.37 V
• K⁺/K = –2.93 V
Step-wise विश्लेषण
• Ag और Hg के E° धनात्मक हैं → ये कमज़ोर अपचायक हैं
• Cr का E° थोड़ा ऋणात्मक है → मध्यम अपचायक
• Mg का E° अधिक ऋणात्मक है → शक्तिशाली अपचायक
• K का E° सबसे अधिक ऋणात्मक है → सबसे शक्तिशाली अपचायक
निष्कर्ष
E° के मान को धनात्मक से ऋणात्मक क्रम में रखने पर अपचायक क्षमता कम से अधिक होती जाती है।
इसलिए क्रम है:
Ag < Hg < Cr < Mg < K
• धातु जितनी आसानी से e⁻ छोड़ेगी, उतनी ही अच्छी अपचायक होगी
• K और Na जैसी क्षार धातुएँ हमेशा सबसे ऊपर reducing power में आती हैं
• परीक्षा ट्रिक:
E° ↓ (more –ve) ⇒ Reducing power ↑
Zn(s) + 2Ag⁺(aq) → Zn²⁺(aq) + 2Ag(s)
अब बताइए—
(i) कौन-सा इलेक्ट्रोड ऋणात्मक आवेशित है?
(ii) सेल में विद्युत धारा के वाहक कौन-से हैं?
(iii) प्रत्येक इलेक्ट्रोड पर होने वाली अभिक्रिया क्या है?
(ii) बाह्य परिपथ में इलेक्ट्रॉन तथा आंतरिक परिपथ (विलयन) में आयन विद्युत धारा के वाहक होते हैं।
(iii)
👉 एनोड पर: Zn(s) → Zn²⁺(aq) + 2e⁻
👉 कैथोड पर: 2Ag⁺(aq) + 2e⁻ → 2Ag(s)
इस गैल्वैनिक सेल में—
• Zn/Zn²⁺ अर्ध-सेल
• Ag⁺/Ag अर्ध-सेल
• दोनों अर्ध-सेलों को लवण सेतु (Salt bridge) से जोड़ा गया है।
सेल संकेत (Cell notation):
Zn(s) | Zn²⁺(aq) || Ag⁺(aq) | Ag(s)
(i) कौन-सा इलेक्ट्रोड ऋणात्मक है?
• जिंक धातु आसानी से इलेक्ट्रॉन त्यागता है।
• जिंक पर ऑक्सीकरण होता है।
• जो इलेक्ट्रोड ऑक्सीकरण करता है, वही एनोड होता है।
अतः— Zn इलेक्ट्रोड ऋणात्मक (Negative) होता है।
(ii) सेल में विद्युत धारा के वाहक
👉 बाह्य परिपथ (तार) में → इलेक्ट्रॉन (e⁻)
👉 आंतरिक परिपथ (विलयन और लवण सेतु) में → आयन (Zn²⁺, Ag⁺, NO₃⁻, K⁺ आदि)
यही मिलकर परिपथ को पूर्ण करते हैं।
(iii) प्रत्येक इलेक्ट्रोड पर अभिक्रिया
एनोड (Zn इलेक्ट्रोड) पर — ऑक्सीकरण:
Zn(s) → Zn²⁺(aq) + 2e⁻
कैथोड (Ag इलेक्ट्रोड) पर — अपचयन:
2Ag⁺(aq) + 2e⁻ → 2Ag(s)
👉 Reduction हमेशा कैथोड पर होता है
👉 गैल्वैनिक सेल में
→ एनोड = ऋणात्मक
→ कैथोड = धनात्मक
👉 इलेक्ट्रॉन हमेशा
एनोड → कैथोड की ओर जाते हैं
• परीक्षा ट्रिक: “ALONE”
(Anode, Left side, Oxidation, -ve charge , Electrode)
(i) 2Cr(s) + 3Cd²⁺(aq) → 2Cr³⁺(aq) + 3Cd(s)
(ii) Fe²⁺(aq) + Ag⁺(aq) → Fe³⁺(aq) + Ag(s)
• E°cell = +0.34 V
• ΔrG° = –196.86 kJ mol⁻¹
• K = 3.17 × 10³⁴
(ii)
• E°cell = +0.03 V
• ΔrG° = –2.895 kJ mol⁻¹
• K = 3.22
Cr³⁺/Cr = –0.74 V
Cd²⁺/Cd = –0.40 V
Fe³⁺/Fe²⁺ = +0.77 V
Ag⁺/Ag = +0.80 V
स्थिरांक:
F = 96500 C mol⁻¹
R = 8.314 J mol⁻¹ K⁻¹
T = 298 K
(i) 2Cr(s) + 3Cd²⁺(aq) → 2Cr³⁺(aq) + 3Cd(s)
Step 1: सेल निरूपण
Cr(s) | Cr³⁺(aq) || Cd²⁺(aq) | Cd(s)
Step 2: मानक सेल-विभव
E°cell = E°(कैथोड) − E°(एनोड)
\( E_{\text{Cell}}^{0} = E_{\text{Cd}^{2+}/\text{Cd}}^{0} - E_{\text{Cr}^{3+}/\text{Cr}}^{0} \)
E°cell = (–0.40) − (–0.74)
E°cell = +0.34 V
Step 3: ΔrG° की गणना
इस अभिक्रिया में इलेक्ट्रॉनों की संख्या, n = 6
ΔrG° = – n F E°cell
ΔrG° = – 6 × 96500 × 0.34
= –196860 J mol⁻¹
= –196.86 kJ mol⁻¹
Step 4: साम्य स्थिरांक (K)
ΔrG° = –2.303 RT log₁₀K
–196860 = –2.303 × 8.314 × 298 × log₁₀K
log K = \( \frac{196860}{2.303 \times 8.314 \times 298} \)
log₁₀K = 34.50
K = antilog(34.50)
K = 3.17 × 10³⁴
(ii) Fe²⁺(aq) + Ag⁺(aq) → Fe³⁺(aq) + Ag(s)
Step 1: सेल निरूपण
Fe²⁺(aq) | Fe³⁺(aq) || Ag⁺(aq) | Ag(s)
Step 2: मानक सेल-विभव
\( E_{\text{Cell}}^{0} = E_{\text{Ag}^{+}/\text{Ag}}^{0} - E_{\text{Fe}^{3+}/\text{Fe}}^{0} \)
E°cell = 0.80 − 0.77
E°cell = +0.03 V
Step 3: ΔrG° की गणना
यहाँ n = 1
ΔrG° = – n F E°cell
ΔrG° = –1 × 96500 × 0.03
= –2895 J mol⁻¹
= –2.895 kJ mol⁻¹
Step 4: साम्य स्थिरांक (K)
ΔrG° = –2.303 RT log₁₀K
–2895 = –2.303 × 8.314 × 298 × log₁₀K
log K = \( \frac{2895}{2.303 \times 8.314 \times 298} \)
log₁₀K = 0.507
K = antilog(0.507)
K = 3.22
👉 ΔrG° ऋणात्मक ⇒ अभिक्रिया आगे की दिशा में जाएगी
👉 E°cell जितना बड़ा ⇒ K उतना बड़ा
👉 पहले E°cell, फिर ΔG°, फिर K निकालना सबसे सही क्रम है
👉 परीक्षा ट्रिक: E°cell ↑ ⇒ ΔG° अधिक ऋणात्मक ⇒ K बहुत बड़ा
(i) Mg(s) | Mg²⁺ (0.001 M) || Cu²⁺ (0.0001 M) | Cu(s)
(ii) Fe(s) | Fe²⁺ (0.001 M) || H⁺ (1 M) | H₂(g) (1 bar) | Pt(s)
(iii) Sn(s) | Sn²⁺ (0.050 M) || H⁺ (0.020 M) | H₂(g) (1 bar) | Pt(s)
(iv) Pt(s) | Br⁻ (0.010 M) | Br₂(l) || H⁺ (0.030 M) | H₂(g) (1 bar) | Pt(s)
(ii) EMF = 0.53 V
(iii) EMF = 0.078 V
(iv) EMF = –1.28 V
सेल अभिक्रिया:
Mg(s) + Cu²⁺(aq) → Mg²⁺(aq) + Cu(s)
n = 2
मानक अपचयन विभव:
E°(Cu²⁺/Cu) = +0.34 V
E°(Mg²⁺/Mg) = −2.37 V
मानक सेल विभव:
\( E_{\text{cell}}^{\circ} = 0.34 - (-2.37) = 2.71\ \mathrm{V} \)
नर्न्स्ट समीकरण:
\( E_{\text{cell}} = E_{\text{cell}}^{\circ} - \frac{0.059}{2}\log\left(\frac{[Mg^{2+}]}{[Cu^{2+}]}\right) \)
\( E_{\text{cell}} = 2.71 - \frac{0.059}{2}\log\left(\frac{0.001}{0.0001}\right) \)
\( E_{\text{cell}} = 2.71 - \frac{0.059}{2}\log(10) \)
Ecell = 2.68 V
(ii) Fe(s) | Fe²⁺ (0.001 M) || H⁺ (1 M) | H₂(g) (1 bar) | Pt(s)
सेल अभिक्रिया:
Fe(s) + 2H⁺(aq) → Fe²⁺(aq) + H₂(g)
n = 2
मानक अपचयन विभव:
E°(H⁺/H₂) = 0.00 V
E°(Fe²⁺/Fe) = −0.44 V
मानक सेल विभव:
\( E_{\text{cell}}^{\circ} = 0 - (-0.44) = 0.44\ \mathrm{V} \)
नर्न्स्ट समीकरण:
\( E_{\text{cell}} = 0.44 - \frac{0.059}{2}\log\left(\frac{[Fe^{2+}]}{[H^+]^2}\right) \)
\( E_{\text{cell}} = 0.44 - \frac{0.059}{2}\log(10^{-3}) \)
\( E_{\text{cell}} = 0.44 + 0.0885 \)
Ecell = 0.53 V
(iii) Sn(s) | Sn²⁺ (0.050 M) || H⁺ (0.020 M) | H₂(g) (1 bar) | Pt(s)
सेल अभिक्रिया:
Sn(s) + 2H⁺(aq) → Sn²⁺(aq) + H₂(g)
n = 2
मानक अपचयन विभव:
E°(Sn²⁺/Sn) = −0.14 V
मानक सेल विभव:
\( E_{\text{cell}}^{\circ} = 0 - (-0.14) = 0.14\ \mathrm{V} \)
नर्न्स्ट समीकरण:
\( E_{\text{cell}} = 0.14 - \frac{0.059}{2}\log\left(\frac{0.050}{(0.020)^2}\right) \)
\( E_{\text{cell}} = 0.14 - \frac{0.059}{2}\log(125) \)
Ecell ≈ 0.078 V
(iv) Pt(s) | Br⁻ (0.010 M) | Br₂(l) || H⁺ (0.030 M) | H₂(g) (1 bar) | Pt(s)
सेल अभिक्रिया:
Br₂(l) + H₂(g) → 2Br⁻(aq) + 2H⁺(aq)
n = 2
मानक अपचयन विभव:
E°(Br₂/Br⁻) = +1.08 V
E°(H⁺/H₂) = 0.00 V
मानक सेल विभव:
\( E_{\text{cell}}^{\circ} = 0 - 1.08 = -1.08\ \mathrm{V} \)
नर्न्स्ट समीकरण:
\( E_{\text{cell}} = -1.08 - \frac{0.059}{2}\log\left(\frac{1}{(0.010)^2(0.030)^2}\right) \)
\( E_{\text{cell}} = -1.08 - \frac{0.059}{2}\log(1.11 \times 10^7) \)
Ecell = –1.288 V
👉 ठोस और शुद्ध द्रव की सांद्रता नर्न्स्ट समीकरण में नहीं आती
👉 H₂ गैस 1 bar पर हो तो उसे समीकरण में नहीं लिखते
👉 पहले E°cell, फिर reaction quotient Q, फिर log term
👉 Ecell का मान −ve हो तो सेल स्वतः कार्य नहीं करेगा
Zn(s) + Ag₂O(s) + H₂O(l) → Zn²⁺(aq) + 2Ag(s) + 2OH⁻(aq)
इस अभिक्रिया के लिए ΔrG° तथा E°cell ज्ञात कीजिए।
• मानक गिब्स ऊर्जा परिवर्तन (ΔrG°) = –2.13 × 10⁵ J mol⁻¹
Ag₂O(s) + H₂O(l) + 2e⁻ → 2Ag(s) + 2OH⁻(aq)
Ag का मानक अपचयन विभव:
\( E_{\mathrm{Ag_2O/Ag}}^{\circ} = +0.344\ V \)
Zn का मानक अपचयन विभव:
Zn²⁺(aq) + 2e⁻ → Zn(s)
\( E_{\mathrm{Zn^{2+}/Zn}}^{\circ} = -0.76\ V \)
Step 1: एनोड और कैथोड की पहचान
• Zn का अपचयन विभव अधिक ऋणात्मक है
→ Zn पर ऑक्सीकरण होगा
→ Zn = एनोड
• Ag₂O का अपचयन विभव अधिक धनात्मक है
→ Ag₂O पर अपचयन होगा
→ Ag₂O = कैथोड
Step 2: मानक सेल विभव की गणना
सूत्र : मानक सेल विभव = कैथोड का E° − एनोड का E°
\( E_{\text{cell}}^{\circ} = E_{\mathrm{Ag_2O/Ag}}^{\circ} - E_{\mathrm{Zn^{2+}/Zn}}^{\circ} \)
\( E_{\text{cell}}^{\circ} = 0.344 - (-0.76) \)
\( E_{\text{cell}}^{\circ} = \mathbf{1.104\ V} \)
Step 3: इलेक्ट्रॉनों की संख्या (n)
दी गई अभिक्रिया में,
Zn → Zn²⁺ + 2e⁻
अतः n = 2
Step 4: ΔrG° की गणना
सूत्र:
\( \Delta_r G^{\circ} = -n F E_{\text{cell}}^{\circ} \)
जहाँ F = 96500 C mol⁻¹
\( \Delta_r G^{\circ} = -2 \times 96500 \times 1.104 \)
\( \Delta_r G^{\circ} = -2.13 \times 10^{5}\ \mathrm{J\ mol^{-1}} \)
👉 E°cell जितना अधिक, सेल उतनी अधिक शक्तिशाली
👉 ΔrG° ऋणात्मक ⇒ अभिक्रिया स्वतःप्रवर्तित
👉 पहले E°cell, फिर ΔrG° निकालना आसान तरीका है
👉 परीक्षा ट्रिक: ΔG° = –nFE° (इस सूत्र से कभी गलती नहीं होती)
• मोलर चालकता (Molar conductivity, Λm)
• सान्द्रता घटाने पर
– चालकता घटती है
– मोलर चालकता बढ़ती है
परिभाषा: किसी विद्युत-अपघट्य के विलयन की वह क्षमता, जिससे वह विद्युत धारा का प्रवाह कराता है, चालकता कहलाती है।
यह प्रतिरोध (R) का व्युत्क्रम होती है।
सूत्र:
चालकता = प्रतिरोध का व्युत्क्रम
\( \kappa = \frac{1}{R} \)
यदि
A = इलेक्ट्रोड का अनुप्रस्थ काट क्षेत्रफल
l = इलेक्ट्रोडों के बीच की दूरी
तो,
\( \kappa = \frac{A}{l} \)
SI इकाई:
सीमेन्ज (Siemens, S)
(Ω⁻¹ के तुल्य)
2. मोलर चालकता (Molar Conductivity)
परिभाषा: वह चालकता जो विलयन में उपस्थित 1 मोल विद्युत-अपघट्य के सभी आयनों द्वारा प्रदर्शित की जाती है, मोलर चालकता कहलाती है। इसे Λm से व्यक्त किया जाता है।
सूत्र:
\( \Lambda_m = \kappa \times V \)
जहाँ
V = वह आयतन जिसमें 1 मोल विद्युत-अपघट्य घुला हो
इकाई:
S cm² mol⁻¹ या Ω⁻¹ cm² mol⁻¹
सान्द्रता के साथ परिवर्तन (Variation with Concentration)
(i) चालकता का परिवर्तन
• सान्द्रता घटाने पर चालकता घटती है।
• कारण: तनुकरण करने पर प्रति इकाई आयतन में आयन की संख्या कम हो जाती है, जिससे विद्युत धारा ले जाने वाले कण कम हो जाते हैं।
👉 इसलिए dilute करने पर κ हमेशा कम होती है (चाहे विद्युत-अपघट्य प्रबल हो या दुर्बल)
(ii) मोलर चालकता का परिवर्तन
• सान्द्रता घटाने पर मोलर चालकता बढ़ती है।
• कारण: तनुकरण पर वह कुल आयतन (V) बढ़ जाता है जिसमें 1 मोल विद्युत-अपघट्य उपस्थित होता है।
• आयतन में वृद्धि, चालकता (κ) में होने वाली कमी से अधिक प्रभावी होती है।
👉 इसलिए Λm = κ × V बढ़ती है।
प्रबल विद्युत-अपघट्य (Strong Electrolytes)
• प्रबल विद्युत-अपघट्यों के लिए मोलर चालकता तनुकरण पर धीरे-धीरे बढ़ती है।
संबंध:
\( \Lambda_m = \Lambda_m^{\circ} - A\sqrt{c} \)
• यदि Λm को √c के विरुद्ध प्लॉट करें, तो सीधी रेखा प्राप्त होती है।
• स्थिरांक A आयनों के आवेश पर निर्भर करता है:
– NaCl → 1–1
– CaCl₂ → 2–1
– MgSO₄ → 2–2
👉 मोलर चालकता (Λm) → 1 मोल विद्युत-अपघट्य की क्षमता
👉 तनुकरण पर
– κ ↓ (हमेशा घटती है)
– Λm ↑ (हमेशा बढ़ती है)
👉 प्रबल विद्युत-अपघट्य में Λm धीरे बढ़ती है
👉 परीक्षा ट्रिक: Dilution → κ कम, Λm ज़्यादा
ताप = 298 K
विलयन की मोलरता = 0.20 mol L⁻¹
विलयन की चालकता (κ) = 0.0248 S cm⁻¹
Step 1: मोलर चालकता का सूत्र
सूत्र : मोलर चालकता = चालकता × 1000 / मोलरता
\( \Lambda_m = \frac{\kappa \times 1000}{\text{मोलरता}} \)
Step 2: मान रखना (units के साथ)
\( \Lambda_m = \frac{0.0248\ \mathrm{S\ cm^{-1}} \times 1000\ \mathrm{cm^3\ L^{-1}}}{0.20\ \mathrm{mol\ L^{-1}}} \)
Step 3: गणना
\( \Lambda_m = 124\ \mathrm{S\ cm^2\ mol^{-1}} \)
👉 κ की unit हमेशा S cm⁻¹ में होनी चाहिए
👉 मोलरता mol L⁻¹ में होनी चाहिए
👉 dilute करने पर मोलर चालकता बढ़ती है
👉 परीक्षा ट्रिक: Λm = κ × 1000 / M
ताप = 298 K
सेल का प्रतिरोध, R = 1500 Ω
विलयन की चालकता, κ = 0.146 × 10⁻³ S cm⁻¹
Step 1: चालकता और प्रतिरोध का संबंध
सूत्र : चालकता (κ) = सेल स्थिरांक / प्रतिरोध (R)
\( \kappa = \frac{\text{सेल स्थिरांक}}{R} \)
Step 2: सेल स्थिरांक का सूत्र
सेल स्थिरांक = κ × R
Step 3: मान रखना (units के साथ)
सेल स्थिरांक = 0.146 × 10⁻³ S cm⁻¹ × 1500 Ω
Step 4: गणना
सेल स्थिरांक = 0.219 cm⁻¹
👉 अच्छे चालकता सेल में सेल स्थिरांक छोटा होता है
👉 पहले हमेशा unit check करो (Ω और S का गुणन)
👉 KCl विलयन को अक्सर मानक विलयन के रूप में प्रयोग किया जाता है
👉 परीक्षा ट्रिक: Cell constant = κ × R
| सांद्रता (M) | 0.001 | 0.010 | 0.020 | 0.050 | 0.100 |
|---|---|---|---|---|---|
| 10² × κ (S m⁻¹) | 1.237 | 11.85 | 23.15 | 55.53 | 106.74 |
• Λₘ बनाम √c का ग्राफ सीधी रेखा देता है।
• ग्राफ को √c = 0 तक extrapolate करने पर
Λ°ₘ (सीमांत मोलर चालकता) ≈ 126 S cm² mol⁻¹
सूत्र (हिंदी में):
मोलर चालकता = चालकता × 1000 / मोलरता
\( \Lambda_m = \frac{\kappa \times 1000}{M} \)
(यहाँ κ को S cm⁻¹ में लिया गया है)
Step 2: Λₘ की गणना (उदाहरण)
0.001 M के लिए:
\( \Lambda_m = \frac{1.237 \times 10^{-4} \times 1000}{0.001} \)
\( \Lambda_m = 123.7\ \mathrm{S\ cm^2\ mol^{-1}} \)
इसी प्रकार शेष सभी सान्द्रताओं के लिए Λₘ निकाले गए हैं।
गणना सारणी
| सान्द्रता (M) | √c (M¹ᐟ²) | κ (S m⁻¹) | κ (S cm⁻¹) | Λₘ (S cm² mol⁻¹) |
|---|---|---|---|---|
| 0.001 | 0.032 | 1.237×10⁻² | 1.237×10⁻⁴ | 123.7 |
| 0.010 | 0.100 | 11.85×10⁻² | 11.85×10⁻⁴ | 118.5 |
| 0.020 | 0.141 | 23.15×10⁻² | 23.15×10⁻⁴ | 115.8 |
| 0.050 | 0.224 | 55.53×10⁻² | 55.53×10⁻⁴ | 111.1 |
| 0.100 | 0.316 | 106.74×10⁻² | 106.74×10⁻⁴ | 106.7 |
Step 3: Λₘ v/s √c का ग्राफ
• X-अक्ष: √c (mol L⁻¹)¹ᐟ²
• Y-अक्ष: Λₘ (S cm² mol⁻¹)
• सभी बिंदुओं को प्लॉट करने पर सीधी रेखा प्राप्त होती है।
• यह प्रबल विद्युत-अपघट्य (NaCl) के लिए अपेक्षित व्यवहार है।
Step 4: सीमांत मोलर चालकता (Λ°ₘ)
• ग्राफ को √c = 0 तक extrapolate किया जाता है।
• Y-अक्ष पर प्राप्त अवरोध (intercept) ही Λ°ₘ होता है।
\( \Lambda_m^{\circ} \approx 124\ \mathrm{S\ cm^2\ mol^{-1}} \)
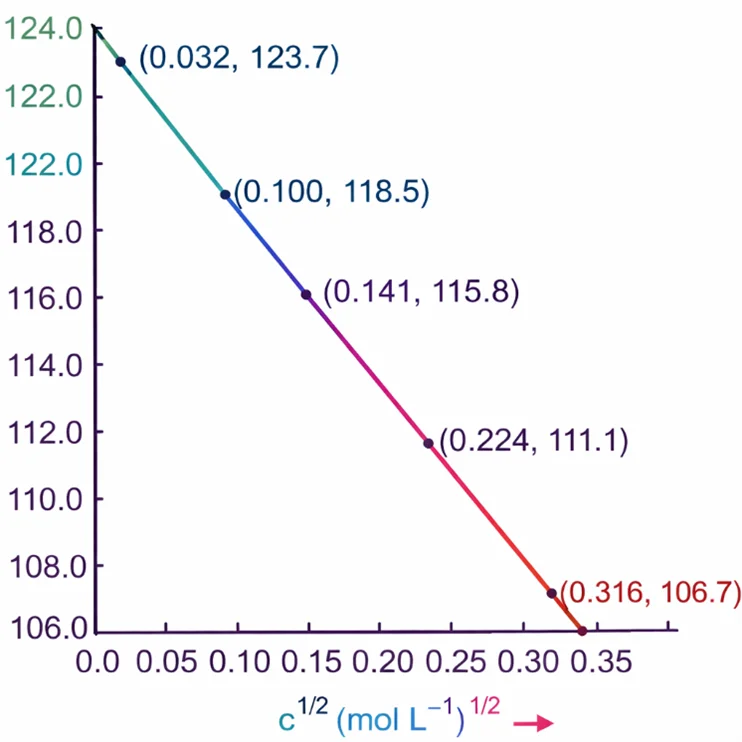
👉 Λₘ = Λ°ₘ − A√c
👉 √c = 0 पर Λₘ = Λ°ₘ
👉 NaCl जैसे 1–1 इलेक्ट्रोलाइट के लिए यह ग्राफ हमेशा सीधी रेखा देता है
👉 परीक्षा ट्रिक: Graph से intercept = Λ°ₘ
• वियोजन की डिग्री (α) = 0.084
• वियोजन स्थिरांक (Ka) = 1.86 × 10⁻⁵
विलयन की मोलरता = 0.00241 mol L⁻¹
चालकता, κ = 7.896 × 10⁻⁵ S cm⁻¹
सीमांत मोलर चालकता, Λ°m = 390.5 S cm² mol⁻¹
Step 1: मोलर चालकता की गणना
सूत्र : मोलर चालकता = चालकता × 1000 / मोलरता
\( \Lambda_m = \frac{7.896 \times 10^{-5} \times 1000}{0.00241} \)
\( \Lambda_m = 32.76\ \mathrm{S\ cm^2\ mol^{-1}} \)
Step 2: वियोजन की डिग्री (α)
सूत्र :
\( \alpha = \frac{\Lambda_m}{\Lambda_m^{\circ}} \)
\( \alpha = \frac{32.76}{390.5} \)
α = 0.084
Step 3: वियोजन स्थिरांक (Ka)
सूत्र :
\( K_a = \frac{C \alpha^2}{1-\alpha} \)
\( K_a = \frac{0.00241 \times (0.084)^2}{1 - 0.084} \)
\( K_a = \frac{0.00241 \times 0.007056}{0.916} \)
\( K_a = 1.86 \times 10^{-5} \)
👉 Λ°m हमेशा अनंत तनुता पर लिया जाता है
👉 Ka = α²c / (1 − α) बहुत महत्वपूर्ण सूत्र है
👉 dilute विलयन में α का मान छोटा होता है
👉 परीक्षा ट्रिक: पहले Λm → फिर α → फिर Ka
(i) 1 मोल Al³⁺ को Al में
(ii) 1 मोल Cu²⁺ को Cu में
(iii) 1 मोल MnO₄⁻ को Mn²⁺ में
(ii) 2 F
(iii) 5 F
🤔 1 मोल इलेक्ट्रॉन का आवेश = 96500 C mol⁻¹ = 1 Faraday (1 F)
🤔 किसी आयन के अपचयन में जितने मोल इलेक्ट्रॉन लगते हैं, उतने ही Faraday आवेश की आवश्यकता होती है।
(i) Al³⁺ → Al
अपचयन अभिक्रिया:
Al³⁺ + 3e⁻ → Al
👉 1 मोल Al³⁺ के लिए
👉 3 मोल इलेक्ट्रॉन चाहिए
📌 अतः आवश्यक आवेश = 3 F
(ii) Cu²⁺ → Cu
अपचयन अभिक्रिया:
Cu²⁺ + 2e⁻ → Cu
👉 1 मोल Cu²⁺ के लिए
👉 2 मोल इलेक्ट्रॉन चाहिए
📌 अतः आवश्यक आवेश = 2 F
(iii) MnO₄⁻ → Mn²⁺ (अम्लीय माध्यम में)
अपचयन अभिक्रिया:
MnO₄⁻ + 8H⁺ + 5e⁻ → Mn²⁺ + 4H₂O
👉 1 मोल MnO₄⁻ के लिए
👉 5 मोल इलेक्ट्रॉन चाहिए (Mn का ऑक्सीकरण अवस्थ = +7 से +2 पर गया है।)
📌 अतः आवश्यक आवेश = 5 F
👉 पहले अपचयन अभिक्रिया लिखो, फिर e⁻ गिनो
👉 जितने e⁻ → उतने Faraday
👉 MnO₄⁻ के प्रश्नों में, अम्लीय माध्यम में e⁻ = 5 याद रखो
👉 परीक्षा ट्रिक: Electrons गिने → Answer मिल गया
(i) गलित CaCl₂ से 20.0 g Ca
(ii) गलित Al₂O₃ से 40.0 g Al
(ii) Al के लिए आवश्यक विद्युत = 4.44 F (लगभग)
👉 1 मोल इलेक्ट्रॉन = 1 Faraday (1 F)
👉 पहले धातु के मोल निकालते हैं,
👉 फिर देखते हैं कि 1 मोल धातु बनाने में कितने e⁻ चाहिए।
(i) गलित CaCl₂ से 20.0 g Ca
Step 1: अपचयन अभिक्रिया
Ca²⁺ + 2e⁻ → Ca
अर्थात 1 मोल Ca के लिए = 2 F
Step 2: Ca का द्रव्यमान
Ca का मोलर द्रव्यमान = 40 g mol⁻¹
Ca के मोल = 1 mol
द्रव्यमान = मोल × मोलर द्रव्यमान
द्रव्यमान = 1 mol × 40 g mol⁻¹ = 40 g
Step 3: Unitary method लगाने पर
| द्रव्यमान (g) | फैराडे (F) |
|---|---|
| 40 | 2 |
| 20 | X |
क्रोस मल्टीप्लाई करके, x का मान निकालने पर:
📌 \( x = \frac{2F \times 20\ g}{40\ g} = 1\ \mathrm{F} \)
(ii) गलित Al₂O₃ से 40.0 g Al
Step 1: अपचयन अभिक्रिया
Al³⁺ + 3e⁻ → Al
अर्थात 1 मोल Al के लिए = 3 F
Step 2: Al का द्रव्यमान
Al का मोलर द्रव्यमान = 27 g mol⁻¹
Al के मोल = 1 mol
द्रव्यमान = मोल × मोलर द्रव्यमान
द्रव्यमान = 1 mol × 27 g mol⁻¹ = 27 g
Step 3: Unitary method लगाने पर
| द्रव्यमान (g) | फैराडे (F) |
|---|---|
| 27 | 3 |
| 40 | X |
📌 \( x = \frac{3F \times 40\ g}{27\ g} = 4.44\ \mathrm{F} \)
👉 Ca²⁺ → Ca ⇒ 2 F
👉 Al³⁺ → Al ⇒ 3 F
👉 परीक्षा ट्रिक: use Unitary method
(i) 1 मोल H₂O को O₂ में
(ii) 1 मोल FeO को Fe₂O₃ में
(ii) 1 F
• 1 मोल इलेक्ट्रॉन पर आवेश = 96500 C mol⁻¹ = 1 Faraday (1 F)
• ऑक्सीकरण में जितने मोल इलेक्ट्रॉन निकलते हैं,
उतने ही Faraday विद्युत की आवश्यकता होती है।
(i) 1 मोल H₂O → O₂
ऑक्सीकरण अर्ध-अभिक्रिया (अम्लीय माध्यम में):
2H₂O → O₂ + 4H⁺ + 4e⁻
👉 2 मोल H₂O से 4 मोल e⁻ निकलते हैं
👉 अतः 1 मोल H₂O से 2 मोल e⁻ निकलेंगे
📌 आवश्यक विद्युत = 2 F
(ii) 1 मोल FeO → Fe₂O₃
ऑक्सीकरण अवस्था का परिवर्तन:
👉 FeO में Fe की ऑक्सीकरण अवस्था = +2
👉 Fe₂O₃ में Fe की ऑक्सीकरण अवस्था = +3
अर्थात:
Fe²⁺ → Fe³⁺ + e⁻
👉 1 मोल Fe²⁺ के लिए 1 मोल e⁻ निकलता है
👉 1 मोल FeO में 1 मोल Fe²⁺ होता है
📌 आवश्यक विद्युत = 1 F
👉 जितने e⁻ निकले → उतने Faraday
👉 H₂O → O₂ के प्रश्नों में
2H₂O → O₂ + 4H⁺ + 4e⁻ याद रखो
👉 Fe²⁺ → Fe³⁺ हमेशा 1 e⁻ देता है
👉 परीक्षा ट्रिक: Oxidation में e⁻ गिनो → Answer मिल गया
धारा (I) = 5 A
समय (t) = 20 मिनट = 20 × 60 s = 1200 s
Ni का मोलर द्रव्यमान = 58.7 g mol⁻¹
फैराडे स्थिरांक (F) = 96500 C mol⁻¹
Step 1: कैथोड पर होने वाली अभिक्रिया
Ni²⁺ + 2e⁻ → Ni
अर्थात 1 मोल Ni के निक्षेपण के लिए 2 मोल इलेक्ट्रॉन चाहिए
⇒ 1 मोल Ni = 2 F = 2 × 96500 C mol⁻¹
Step 2: Ni का द्रव्यमान निकालना
Ni का मोलर द्रव्यमान = 58.7 g mol⁻¹
Ni के मोल = 1 mol
द्रव्यमान = मोल X मोलर द्रव्यमान
द्रव्यमान = 1 mol x 58.7 g mol-1 = 58.7 g
Step 3: प्रवाहित कुल आवेश (Q)
सूत्र : आवेश = धारा × समय
Q = I × t
Q = 5 × 1200 = 6000 C
Step 4: Step 4: Unitary method लगाने पर
| द्रव्यमान (g) | आवेश (C) |
|---|---|
| 58.7 | 2 × 96500 |
| X | 6000 |
क्रोस मल्टीप्लाई करने पर:
📌 \( x = \frac{58.7\ g \times 6000\ C}{2 \times 96500\ C} = 1.83\ g \)
👉 पहले हमेशा कैथोड अभिक्रिया लिखो
👉 Ni²⁺ → Ni ⇒ 2 e⁻ (यह याद रखो)
👉 समय को सेकंड में बदलना न भूलो
👉 परीक्षा ट्रिक: use Unitary method
(i) विद्युत-धारा कितने समय तक प्रवाहित हुई?
(ii) निक्षेपित कॉपर (Cu) तथा जिंक (Zn) का द्रव्यमान ज्ञात कीजिए।
📌 निक्षेपित Cu का द्रव्यमान = 0.426 g (लगभग)
📌 निक्षेपित Zn का द्रव्यमान = 0.44 g (लगभग)
👉 श्रेणीक्रम (series) में जुड़े सभी सेलों में, समान आवेश (Q) प्रवाहित होता है।
👉 1 Faraday (1 F) = 96500 C
👉 पहले Ag से आवेश और समय निकालते हैं, फिर उसी आवेश से Cu और Zn का द्रव्यमान।
Step 1: सिल्वर (Ag) से समय निकालना
कैथोड अभिक्रिया (AgNO₃):
Ag⁺ + e⁻ → Ag
👉 1 mol Ag (108 g) के लिए = 1 F = 96500 C
Unitary Method
| द्रव्यमान (g) | आवेश (C) |
|---|---|
| 108 | 96500 |
| 1.45 | X |
क्रोस मल्टीप्लाई करने पर:
📌 \( x = \frac{96500 \times 1.45}{108} = 1295.6\ \mathrm{C} \)
अब,
Q = I × t
📌 \( t = \frac{1295.6}{1.5} = 863.7\ \mathrm{s} \approx 14\ \mathrm{min}\ 24\ \mathrm{s} \)
Step 2: निक्षेपित कॉपर (Cu) का द्रव्यमान
कैथोड अभिक्रिया (CuSO₄):
Cu²⁺ + 2e⁻ → Cu
👉 1 mol Cu (63.5 g) के लिए = 2 F = 2 × 96500 C
Unitary Method
| द्रव्यमान (g) | आवेश (C) |
|---|---|
| 63.5 | 2 × 96500 |
| X | 1295.6 |
📌 \( x = \frac{63.5 \times 1295.6}{2 \times 96500} = 0.426\ \mathrm{g} \)
Step 3: निक्षेपित जिंक (Zn) का द्रव्यमान
कैथोड अभिक्रिया (ZnSO₄):
Zn²⁺ + 2e⁻ → Zn
👉 1 mol Zn (65.4 g) के लिए = 2 F = 2 × 96500 C
Unitary Method
| द्रव्यमान (g) | आवेश (C) |
|---|---|
| 65.4 | 2 × 96500 |
| X | 1295.6 |
📌 \( x = \frac{65.4 \times 1295.6}{2 \times 96500} = 0.44\ \mathrm{g} \)
👉 पहले जिस धातु का द्रव्यमान दिया हो (यहाँ Ag), उसी से Q और समय निकालो
👉 फिर उसी Q से बाकी धातुओं का द्रव्यमान निकालो
👉 Ag⁺ → Ag ⇒ 1 F
👉 Cu²⁺, Zn²⁺ → धातु ⇒ 2 F
👉 परीक्षा ट्रिक: Unitary method = सबसे safe और fast तरीका
(i) Fe³⁺(aq) और I⁻(aq)
(ii) Ag⁺(aq) और Cu(s)
(iii) Fe³⁺(aq) और Br⁻(aq)
(iv) Ag(s) और Fe³⁺(aq)
(v) Br₂(aq) और Fe²⁺(aq)
(ii) अभिक्रिया संभव है
(iii) अभिक्रिया संभव नहीं है
(iv) अभिक्रिया संभव नहीं है
(v) अभिक्रिया संभव है
👉 जिस युग्म का मानक अपचयन विभव (E°) अधिक होता है, वह अपचयन करेगा
👉 जिसका E° कम होता है, वह ऑक्सीकरण करेगा
👉 कोई भी रेडॉक्स अभिक्रिया तभी संभव होती है जब E°cell धनात्मक हो
\( E_{\mathrm{cell}}^{\circ} = E_{\text{कैथोड}}^{\circ} - E_{\text{एनोड}}^{\circ} \)
प्रयुक्त मानक अपचयन विभव (तालिका 2.1 से)
👉 Fe³⁺/Fe²⁺ = +0.77 V
👉 I₂/I⁻ = +0.54 V
👉 Ag⁺/Ag = +0.80 V
👉 Cu²⁺/Cu = +0.34 V
👉 Br₂/Br⁻ = +1.09 V
(i) Fe³⁺(aq) और I⁻(aq)
अभिक्रिया: Fe³⁺ + I⁻ → Fe²⁺ + ½ I₂
सेल निरूपण: Pt | I₂ | I⁻ || Fe³⁺ | Fe²⁺
\( E_{\mathrm{cell}}^{\circ} = 0.77 - 0.54 = +0.23\ V \)
✔ E°cell धनात्मक ⇒ अभिक्रिया संभव
(ii) Ag⁺(aq) और Cu(s)
अभिक्रिया: Cu + Ag⁺ → Cu²⁺ + Ag
सेल निरूपण: Cu | Cu²⁺ || Ag⁺ | Ag
\( E_{\mathrm{cell}}^{\circ} = 0.80 - 0.34 = +0.46\ V \)
✔ E°cell धनात्मक ⇒ अभिक्रिया संभव
(iii) Fe³⁺(aq) और Br⁻(aq)
अभिक्रिया: Br⁻ + Fe³⁺ → ½ Br₂ + Fe²⁺
सेल निरूपण: Br⁻ | ½ Br₂ || Fe³⁺ | Fe²⁺
\( E_{\mathrm{cell}}^{\circ} = 0.77 - 1.09 = -0.32\ V \)
✘ E°cell ऋणात्मक ⇒ अभिक्रिया संभव नहीं
(iv) Ag(s) और Fe³⁺(aq)
अभिक्रिया: Ag + Fe³⁺ → Ag⁺ + Fe²⁺
सेल निरूपण: Ag | Ag⁺ || Fe³⁺ | Fe²⁺
\( E_{\mathrm{cell}}^{\circ} = 0.77 - 0.80 = -0.03\ V \)
✘ E°cell ऋणात्मक ⇒ अभिक्रिया संभव नहीं
(v) Br₂(aq) और Fe²⁺(aq)
अभिक्रिया: Fe²⁺ + ½ Br₂ → Fe³⁺ + Br⁻
सेल निरूपण: Fe²⁺ | Fe³⁺ || ½ Br₂ | Br⁻
\( E_{\mathrm{cell}}^{\circ} = 1.09 - 0.77 = +0.31\ V \)
✔ E°cell धनात्मक ⇒ अभिक्रिया संभव
👉 E°cell < 0 ⇒ अभिक्रिया नहीं होगी
👉 अधिक धनात्मक E° वाला युग्म हमेशा अपचयित होता है
👉 परीक्षा ट्रिक: Positive E°cell = Possible reaction
(i) सिल्वर इलेक्ट्रोडों के साथ AgNO₃ का जलीय विलयन
(ii) प्लैटिनम इलेक्ट्रोडों के साथ AgNO₃ का जलीय विलयन
(iii) प्लैटिनम इलेक्ट्रोडों के साथ H₂SO₄ का तनु विलयन
(iv) प्लैटिनम इलेक्ट्रोडों के साथ CuCl₂ का जलीय विलयन
👉 कैथोड पर: Ag(s)
👉 ऐनोड पर: Ag⁺(aq)
(ii) AgNO₃ (aq) + प्लैटिनम इलेक्ट्रोड
👉 कैथोड पर: Ag(s)
👉 ऐनोड पर: O₂(g)
(iii) H₂SO₄ (तनु) + प्लैटिनम इलेक्ट्रोड
👉 कैथोड पर: H₂(g)
👉 ऐनोड पर: O₂(g)
(iv) CuCl₂ (aq) + प्लैटिनम इलेक्ट्रोड
👉 कैथोड पर: Cu(s)
👉 ऐनोड पर: Cl₂(g)
विलयन में आयनीकरण:
AgNO₃(aq) → Ag⁺(aq) + NO₃⁻(aq)
H₂O(l) ⇌ H⁺(aq) + OH⁻(aq)
कैथोड पर (अपचयन):
Ag⁺/Ag का मानक अपचयन विभव (+0.80 V) जल के अपचयन विभव (−0.83 V) से अधिक होता है।
अतः Ag⁺ आयन अपचयित होता है:
Ag⁺(aq) + e⁻ → Ag(s)
ऐनोड पर (ऑक्सीकरण):
सिल्वर इलेक्ट्रोड सक्रिय होता है, अतः वह स्वयं ऑक्सीकृत हो जाता है:
Ag(s) → Ag⁺(aq) + e⁻
👉 इसलिए ऐनोड पर O₂ गैस मुक्त नहीं होती।
(ii) AgNO₃ (aq) + प्लैटिनम इलेक्ट्रोड
प्लैटिनम इलेक्ट्रोड निष्क्रिय होता है।
कैथोड पर:
Ag⁺(aq) + e⁻ → Ag(s)
ऐनोड पर:
जल का ऑक्सीकरण होता है:
H₂O(l) → ½O₂(g) + 2H⁺(aq) + 2e⁻
👉 ऐनोड पर O₂ गैस मुक्त होती है।
(iii) तनु H₂SO₄ (aq) + प्लैटिनम इलेक्ट्रोड
विलयन में आयनीकरण:
H₂SO₄(aq) → 2H⁺(aq) + SO₄²⁻(aq)
कैथोड पर:
2H⁺(aq) + 2e⁻ → H₂(g)
ऐनोड पर:
2H₂O(l) → O₂(g) + 4H⁺(aq) + 4e⁻
👉 कैथोड पर H₂ तथा ऐनोड पर O₂ गैस प्राप्त होती है।
(iv) CuCl₂ (aq) + प्लैटिनम इलेक्ट्रोड
विलयन में आयनीकरण:
CuCl₂(aq) → Cu²⁺(aq) + 2Cl⁻(aq)
कैथोड पर:
Cu²⁺/Cu का मानक अपचयन विभव (+0.34 V) जल के अपचयन विभव (−0.83 V) से अधिक होता है।
अतः Cu²⁺ आयन अपचयित होता है:
Cu²⁺(aq) + 2e⁻ → Cu(s)
ऐनोड पर:
यद्यपि जल का ऑक्सीकरण विभव कम है, लेकिन O₂ के लिए overpotential अधिक होने तथा Cl⁻ आयनों की अधिक सांद्रता के कारण व्यवहार में:
2Cl⁻(aq) → Cl₂(g) + 2e⁻
👉 ऐनोड पर Cl₂ गैस मुक्त होती है।
👉 Active electrode (Ag) खुद ऑक्सीकृत हो सकता है
👉 Inert electrode (Pt) पर प्रायः जल का अपघटन होता है
👉 Ag⁺ और Cu²⁺ जैसे आयन जल से पहले discharge होते हैं
👉 परीक्षा ट्रिक: Higher reduction potential → पहले discharge
Chapter 2 Electrochemistry क्यों है ज़रूरी?
Electrochemistry से जुड़े प्रश्न CBSE Board Exams, school tests और competitive exams में नियमित रूप से पूछे जाते हैं। इस chapter में numerical problems के साथ-साथ theory-based questions भी आते हैं, जिनमें सही concept clarity बहुत जरूरी होती है।
इस chapter में मुख्य रूप से पढ़ाया जाता है:
- Electrochemical cells
- Galvanic और Electrolytic cells
- Electrode potential और EMF of cell
- Nernst equation
- Conductance और Molar conductivity
- Electrolysis
- Batteries और corrosion
NCERT Solutions Class 12 Chemistry Electrochemistry in Hindi की खास बातें
- सभी NCERT exercise questions के पूरे समाधान
- आसान और exam-oriented Hindi language
- Numerical questions को step-by-step method से solve किया गया
- Important formulas और units को clearly explain किया गया
- Board exam में पूछे जाने वाले important questions पर focus
ये solutions self-study के लिए भी useful हैं और revision के समय भी बहुत मदद करते हैं।
किसके लिए सबसे ज़्यादा उपयोगी?
यह content खास तौर पर उपयोगी है:
- Class 12 CBSE students
- Hindi medium students
- Board exam 2026 की तैयारी करने वाले छात्र
- JEE / NEET level basics मजबूत करने वाले learners
अगर आप concept समझकर questions solve करना चाहते हैं, तो ये NCERT solutions आपके लिए सही रहेंगे।
Exam Preparation में कैसे मदद करेंगे ये Solutions?
- Concepts clear होने से theory questions आसान हो जाते हैं
- Numericals में calculation mistakes कम होती हैं
- Answers लिखने का सही तरीका समझ में आता है
- Time management और confidence दोनों improve होते हैं
Regular practice के साथ अगर आप इन solutions को follow करते हैं, तो Electrochemistry एक scoring chapter बन सकता है।
Chapter 2 Electrochemistry NCERT Solutions (Hindi) – PDF और Online Access
इस पोस्ट में दिए गए solutions आप online पढ़ सकते हैं और future revision के लिए PDF format में भी इस्तेमाल कर सकते हैं। इससे आप कभी भी, कहीं भी chapter revise कर सकते हैं।
